Den fase af stof, der udsættes for normalt atmosfærisk tryk, udelukkende afhængig af?
Her er hvorfor:
* Temperatur og molekylær bevægelse: Temperaturen er et mål for den gennemsnitlige kinetiske energi af molekyler. Højere temperaturer betyder hurtigere bevægende molekyler.
* faser af stof: De forskellige faser af stof (fast, flydende, gas) er defineret af styrken af de intermolekylære kræfter mellem molekyler og deres bevægelse.
* Normalt atmosfærisk tryk: Ved normalt atmosfærisk tryk er det tryk, der udøves af atmosfæren på stoffet, relativt konstant. Dette tryk spiller en rolle i bestemmelsen af kogepunktet for en væske, men det bestemmer ikke fasen ved en given temperatur.
Eksempel:
* Vand: Ved normalt atmosfærisk tryk findes vand som en fast (is) under 0 ° C, en væske (vand) mellem 0 ° C og 100 ° C og en gas (damp) over 100 ° C.
Mens tryk kan påvirke fasen af et stof (for eksempel stigende tryk kan forårsage et stof til at flyve ved en højere temperatur) ved det normale atmosfæriske tryk, er temperaturen den primære faktor, der bestemmer stoffasen.
 Varme artikler
Varme artikler
-
 Bygger den bedste zeolitZeolit. Kredit:Hannes Grobe, CC BY-SA 2.5 , via Wikimedia Commons Hvis videnskaben og naturen skulle have en baby, ville det helt sikkert være zeolitten. Denne specielle sten, med sin porøse strukt
Bygger den bedste zeolitZeolit. Kredit:Hannes Grobe, CC BY-SA 2.5 , via Wikimedia Commons Hvis videnskaben og naturen skulle have en baby, ville det helt sikkert være zeolitten. Denne specielle sten, med sin porøse strukt -
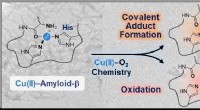 Koordinationskemi og Alzheimers sygdomKemiske modifikationer af koordinationssfæren i Cu(II)-amyloid-β ved hjælp af kobber-O2 kemi. Kredit:KAIST Det er for nylig blevet tydeligt, at interaktionerne mellem kobber og amyloid-β neurotoks
Koordinationskemi og Alzheimers sygdomKemiske modifikationer af koordinationssfæren i Cu(II)-amyloid-β ved hjælp af kobber-O2 kemi. Kredit:KAIST Det er for nylig blevet tydeligt, at interaktionerne mellem kobber og amyloid-β neurotoks -
 Singlet oxygen nedbryder selektivt oxytetracyclin i fentonlignende oxidationMekanismediagram over Co/C+H 2 O 2 system til selektiv nedbrydning af OTC -forurenende stoffer. Kredit:HONG Peidong For nylig, et forskergruppe ledet af Prof. 2 O 2 ) for at generere singl
Singlet oxygen nedbryder selektivt oxytetracyclin i fentonlignende oxidationMekanismediagram over Co/C+H 2 O 2 system til selektiv nedbrydning af OTC -forurenende stoffer. Kredit:HONG Peidong For nylig, et forskergruppe ledet af Prof. 2 O 2 ) for at generere singl -
 Sådan binder du bomuld med agern og rustTie-dyeing bomuldsstof med agern og rustløsninger gør det brunt, orange, blåt og sort. Kredit:Tilpasset fra Journal of Chemical Education 2022, DOI:10.1021/acs.jchemed.2c00086 Tie-dyeing er en sjov
Sådan binder du bomuld med agern og rustTie-dyeing bomuldsstof med agern og rustløsninger gør det brunt, orange, blåt og sort. Kredit:Tilpasset fra Journal of Chemical Education 2022, DOI:10.1021/acs.jchemed.2c00086 Tie-dyeing er en sjov
- Farvens lyshed eller mørke?
- Forskere anvender eksperimentel økonomi til mexicansk vandmangel
- Inkluderer et fri kropsdiagram kun den tyngdekraft, der virker på et objekt?
- Hvorfor ser du skyggen af et fly, når det flyver over dig?
- Dramatisk handling nødvendig mod klimaændringer:FN
- Undervisning i gruppearbejde til elever med autisme


