En forbindelse, der har et specifikt antal vandmolekyler bundet til dets atomer?
Her er en sammenbrud:
* Hydrat: En forbindelse, der indeholder vandmolekyler inden for dens krystalstruktur.
* hydratiseringsvand: Vandmolekylerne, der er kemisk bundet til forbindelsen.
* vandfri: En forbindelse, der ikke indeholder vand af hydratisering.
Eksempler på hydrater:
* kobber (ii) sulfatpentahydrat (cuso₄ · 5H₂o): Denne forbindelse indeholder fem vandmolekyler bundet til hver kobbersulfatenhed.
* natriumcarbonat decahydrat (na₂co₃ · 10H₂o): Denne forbindelse indeholder ti vandmolekyler bundet til hver natriumcarbonatenhed.
* Epsom -salte (MGSO₄ · 7H₂O): Denne forbindelse indeholder syv vandmolekyler bundet til hver magnesiumsulfatenhed.
hvordan man navngiver hydrater:
* Navnet på forbindelsen efterfølges af præfikset "hydrat".
* Præfikset angiver antallet af vandmolekyler pr. Formelenhed.
* For eksempel betyder "mono" en "Di" betyder to, "tri" betyder tre osv.
Vigtig note: Hydrater kan miste deres vandvand, når de opvarmes, danner en vandfri forbindelse. Denne proces kaldes dehydrering .
 Varme artikler
Varme artikler
-
 Glow-in-the-mørke papir som en hurtig test for infektionssygdommeDenne papirstrimmel (ekstremt zoomet ind) indeholder to kopier af testen. De tre lysende prikker pr. test indikerer, at du kan kontrollere tre forskellige antistoffer inden for en test. Kredit:Bart va
Glow-in-the-mørke papir som en hurtig test for infektionssygdommeDenne papirstrimmel (ekstremt zoomet ind) indeholder to kopier af testen. De tre lysende prikker pr. test indikerer, at du kan kontrollere tre forskellige antistoffer inden for en test. Kredit:Bart va -
 Brændstof ud af den blå luft:Ny vej til opsamling og opgradering af CO2Geonhui Lee, Ph.d. -kandidat, driver en elektrolysator, der er i stand til at omdanne opløst carbonat til CO2 og derefter til syngas. Enheden tilbyder en ny, kortere vej til omdannelse af atmosfærisk
Brændstof ud af den blå luft:Ny vej til opsamling og opgradering af CO2Geonhui Lee, Ph.d. -kandidat, driver en elektrolysator, der er i stand til at omdanne opløst carbonat til CO2 og derefter til syngas. Enheden tilbyder en ny, kortere vej til omdannelse af atmosfærisk -
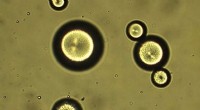 Dråber af flydende krystalmolekyler forgrener sig til mærkelige strukturerMens mange videnskabelige resultater kommer fra lange års omhyggelig planlægning, en gang imellem falder forskere over noget helt uventet. I begyndelsen, vi søgte at skabe en bestemt effekt, siger ka
Dråber af flydende krystalmolekyler forgrener sig til mærkelige strukturerMens mange videnskabelige resultater kommer fra lange års omhyggelig planlægning, en gang imellem falder forskere over noget helt uventet. I begyndelsen, vi søgte at skabe en bestemt effekt, siger ka -
 Gør det nemmere at opfange kuldioxid i cementindustrienCement er et af verdens mest almindelige byggematerialer, og dens fremstilling tegner sig for syv procent af vores drivhusgasudledning. Det er vi nødt til at gøre noget ved. Dette billede er taget i S
Gør det nemmere at opfange kuldioxid i cementindustrienCement er et af verdens mest almindelige byggematerialer, og dens fremstilling tegner sig for syv procent af vores drivhusgasudledning. Det er vi nødt til at gøre noget ved. Dette billede er taget i S
- Forskere opdager, hvordan nøgleenzym involveret i aldring, kræft samler sig
- Modellering af bredere virkninger af naturbrande i Sibirien
- Hvad har en elektron mere end natrium?
- Udfældningsprodukter fra Antarctic Mesoscale Prediction System viser sig at være pålidelige
- Hvad er overfladekøling, der resulterer, når et stof fordamper?
- Forskere viser, hvordan dødelige vulkanske fænomener bevæger sig


