Hvorfor forbrænder metaller med forskellige farvede flammer?
1. varme og excitation: Når et metal opvarmes, absorberer dets elektroner energi og springer til højere energiniveau og bliver "ophidset".
2. vender tilbage til jordtilstand: Disse ophidsede elektroner er ustabile og vil vende tilbage til deres originale, lavere energiniveau (jordtilstand).
3. Emission af lys: Når de ophidsede elektroner falder tilbage til deres jordtilstand, frigiver de den absorberede energi i form af lys. Farven på dette lys afhænger af den specifikke energiforskel mellem de ophidsede og jordtilstande.
4. Unikke energiniveau: Hvert metal har et unikt arrangement af elektroner og energiniveau. Dette betyder, at energiforskellene mellem deres ophidsede og jordtilstande også er unikke, hvilket fører til emission af forskellige farvede lys.
Eksempler:
* natrium (NA): Forbrænder med en lys gul flamme.
* kalium (k): Brænder med en syrinflamme.
* calcium (CA): Forbrænder med en orange-rød flamme.
* kobber (CU): Brænder med en grøn flamme.
* barium (BA): Forbrænder med en grøn-gul flamme.
flammeforsøg:
Dette fænomen bruges i analytisk kemi til flammeforsøg , hvor en prøve af et ukendt metal opvarmes i en flamme for at observere farven på det udsendte lys. Dette hjælper med at identificere det metal, der er til stede i prøven.
Vigtig note: Farverne på flammer kan også påvirkes af andre faktorer som tilstedeværelsen af andre elementer, temperaturen på flammen og tilstedeværelsen af urenheder.
 Varme artikler
Varme artikler
-
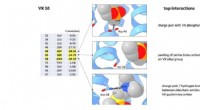 Teamet skaber den første VX-neurotoksindetektor nogensindeEt VX-detekterende protein designet af Koder Lab på CCNY. Kredit:Koder Lab/CCNY City College of New York lektor i fysik Ronald Koder og hans team ved Koder Lab fremmer området for molekylær detekti
Teamet skaber den første VX-neurotoksindetektor nogensindeEt VX-detekterende protein designet af Koder Lab på CCNY. Kredit:Koder Lab/CCNY City College of New York lektor i fysik Ronald Koder og hans team ved Koder Lab fremmer området for molekylær detekti -
 Forskere nedbryder plastikaffaldDesign af en sterisk indesluttet bipyridin-ruthenium (Ru) ramme tillader kontrolleret indeslutning af adsorberet H2 og dets levering til inerte amider, hvilket muliggør katalytisk hydrogenering af en
Forskere nedbryder plastikaffaldDesign af en sterisk indesluttet bipyridin-ruthenium (Ru) ramme tillader kontrolleret indeslutning af adsorberet H2 og dets levering til inerte amider, hvilket muliggør katalytisk hydrogenering af en -
 Ny teknik til at identificere kilden til madforgiftningKredit:CC0 Public Domain Forskere ved University of Aberdeen har udviklet en ny teknik, der kan hjælpe med at identificere kilden til madforgiftning eller infektion hurtigere og mere præcist end d
Ny teknik til at identificere kilden til madforgiftningKredit:CC0 Public Domain Forskere ved University of Aberdeen har udviklet en ny teknik, der kan hjælpe med at identificere kilden til madforgiftning eller infektion hurtigere og mere præcist end d -
 At bringe den grønne revolution til elektronikKredit:CC0 Public Domain Forskere undersøger, hvordan man laver elektroniske komponenter fra miljøvenlige, biologisk nedbrydelige materialer for at hjælpe med at løse et voksende folkesundheds- og
At bringe den grønne revolution til elektronikKredit:CC0 Public Domain Forskere undersøger, hvordan man laver elektroniske komponenter fra miljøvenlige, biologisk nedbrydelige materialer for at hjælpe med at løse et voksende folkesundheds- og
- Hvordan hænger homogen blanding og opløsning sammen?
- Forekomsten af magnetisme i universet
- Hvordan blev de trojanske asteroider opdaget og navngivet?
- Arkæologer samler, hvordan besætningen overlevede skibbrud i Alaska i 1813
- Hvad er følgende som et eksempel på kemisk forandring?
- Hvad er den fysiske kemi?


