Kan en amfoterisk sammensætning fungere som syre og en base?
Her er en sammenbrud:
* amfoteriske forbindelser Kan fungere som både syrer og baser, afhængigt af reaktionsmiljøet.
* syrer Doner protoner (H+ -ioner) i en reaktion.
* baser Accepter protoner (H+ -ioner) i en reaktion.
Eksempler på amfoteriske forbindelser:
* vand (H2O):
* Som syre:H2O → H + + OH- (donerer en proton)
* Som base:H2O+ H+ → H3O+ (accepterer en proton)
* aluminium hydroxid (AL (OH) 3):
* Som syre:Al (OH) 3 + 3H + → Al3 + + 3H2O (donerer protoner)
* Som base:AL (OH) 3 + OH- → [AL (OH) 4]- (accepterer protoner)
* carbonation (CO32-):
* Som syre:CO32- + H + → HCO3- (accepterer en proton)
* Som base:CO32- + H2O → HCO3- + OH- (donerer en proton)
Key Takeaway: Amfoteriske forbindelser kan flytte deres opførsel til enten at donere eller acceptere protoner afhængigt af det omgivende kemiske miljø. Dette gør dem vigtige i forskellige kemiske reaktioner og biologiske systemer.
Sidste artikelHvad er et rent stof klassificeret som?
Næste artikelHvad er de forskellige videnskabelige instrumenter?
 Varme artikler
Varme artikler
-
 Ny træ-metal-hybrid til letvægtskonstruktionFra et økologisk synspunkt, træskum er ideelle til en lang række anvendelser. Kredit:Fraunhofer WKI Træskum og metalsvamp – kan de kombineres? Det var spørgsmålet, som eksperter ved Fraunhofer Ins
Ny træ-metal-hybrid til letvægtskonstruktionFra et økologisk synspunkt, træskum er ideelle til en lang række anvendelser. Kredit:Fraunhofer WKI Træskum og metalsvamp – kan de kombineres? Det var spørgsmålet, som eksperter ved Fraunhofer Ins -
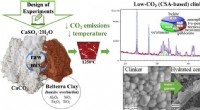 Alternativ cement med lavt CO2-fodaftryk udvikletGrafisk abstrakt. Kredit:DOI:10.1016/j.susmat.2021.e00299 Forskere ved Martin Luther University Halle-Wittenberg (MLU) i Tyskland og det brasilianske universitet i Pará har udviklet et klimavenlig
Alternativ cement med lavt CO2-fodaftryk udvikletGrafisk abstrakt. Kredit:DOI:10.1016/j.susmat.2021.e00299 Forskere ved Martin Luther University Halle-Wittenberg (MLU) i Tyskland og det brasilianske universitet i Pará har udviklet et klimavenlig -
 Fremtrædende akademikere efterlyser mere videnskab inden for retsmedicinSalk neuroforsker Thomas Albright studerer syn og hukommelse. Kredit:Salk Instituttet Da retsvidenskaben står over for stigende kontrol, da den spiller en stadig mere fremtrædende rolle i retsplej
Fremtrædende akademikere efterlyser mere videnskab inden for retsmedicinSalk neuroforsker Thomas Albright studerer syn og hukommelse. Kredit:Salk Instituttet Da retsvidenskaben står over for stigende kontrol, da den spiller en stadig mere fremtrædende rolle i retsplej -
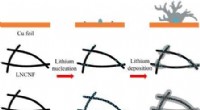 En letvægts nanofiberbaseret opsamlerSkematisk diagram af lithiumkernedannelse og aflejringsadfærd på Cu-folie, lavt nitrogen-dopingniveau carbon nanofiber-ramme og højt nitrogen-doping-niveau carbon-nanofiber-framework. Kredit:©Science
En letvægts nanofiberbaseret opsamlerSkematisk diagram af lithiumkernedannelse og aflejringsadfærd på Cu-folie, lavt nitrogen-dopingniveau carbon nanofiber-ramme og højt nitrogen-doping-niveau carbon-nanofiber-framework. Kredit:©Science
- Zuckerberg møder EU-embedsmænd, mens blokkens nye teknologiregler tårner sig op
- Hvad er brugen af grafit?
- Når Kinas forsknings- og udviklingsfinansiering ud til de rigtige virksomheder?
- Hvad har mere masse end en blyant?
- Kvinder, der sparker mål på banen, men takler stadig rodfæstet sexisme
- Vil stærk og hurtigt skiftende kunstig muskel være mulig?


