Når 30 g is ved 0C blandes med 500 g vand 45C i en jernbeholder 150 g masse og omrøres, indtil den all smelter temperatur samme hvilken endelige temperatur?
1. Definer variabler:
* m_ice: Masse is =30 g
* m_water: Masse vand =500 g
* m_iron: Masse af jernbeholder =150 g
* t_ice: Den oprindelige temperatur på is =0 ° C
* t_water: Den oprindelige temperatur på vand =45 ° C
* t_final: Den endelige temperatur på blandingen (hvad vi vil finde)
* l_fusion: Latent fusionsvarme af is =334 j/g
* c_water: Specifik varmekapacitet af vand =4,18 J/(G ° C)
* c_iron: Specifik varmekapacitet på jern =0,45 J/(G ° C)
2. Opret varmebalance ligning:
Den samlede varme, der er opnået af isen (smeltning og opvarmning), skal svare til den samlede varme, der mistes med vand- og jernbeholderen, når de køler ned:
* varme opnået af is =varme tabt af vand + varme tabt af jern
3. Nedbryde varmen:
* varme opnået af is:
* smeltning: m_ice * l_fusion
* Opvarmning: m_ice * c_water * (t_final - t_ice)
* varme tabt af vand: m_water * c_water * (t_water - t_final)
* varme tabt af jern: m_iron * c_iron * (t_water - t_final)
4. Tilslut værdierne og løs:
(30 g * 334 j/g) + (30 g * 4,18 j/(g ° C) * (t_final - 0 ° C)) =(500 g * 4,18 j/(g ° C) * (45 ° C - T_Final)) + (150 g * 0,45 J/(g ° C) * (45 ° C - T_Final))) + (150 g * 0,45 J/(g ° C) * (45 ° C - T_Final)))) + (150 g * 0,45 J/(g ° C) * (45 ° C - T_Final)))))
5. Forenkle og løse for T_Final:
* 10020 J + 125,4 J/° C * T_Final =9390 J - 2090 J/° C * T_Final + 3037,5 J - 67,5 J/° C * T_Final
* 2283 J/° C * T_Final =1578,5 J
* T_Final ≈ 0,69 ° C
Derfor er blandingens endelige temperatur ca. 0,69 ° C.
Sidste artikelHvilken ville have et lavere kogepunkt NaCl eller SCL2?
Næste artikelHvad er 38,6cin Fahrenheit?
 Varme artikler
Varme artikler
-
 Bibliotek af edderkoppesilke kunne rumme hemmeligheder for nye materialerSølvhaveedderkopper (Argiope argentata) sidder i deres spind i Cheryl Hayashis laboratorium på American Museum of Natural History i New York. Edderkoppesilker starter alle på samme måde:en klud goo, b
Bibliotek af edderkoppesilke kunne rumme hemmeligheder for nye materialerSølvhaveedderkopper (Argiope argentata) sidder i deres spind i Cheryl Hayashis laboratorium på American Museum of Natural History i New York. Edderkoppesilker starter alle på samme måde:en klud goo, b -
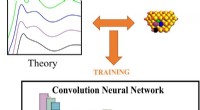 Maskinlæringsanalyse af røntgendata udvælger vigtige katalytiske egenskaberDette skema viser, hvordan spektre afledt af teoriberegninger ved hjælp af kendte strukturer (øverst) kan bruges til at træne et neuralt netværk (i midten), som så kan bruge sin samlede viden til at o
Maskinlæringsanalyse af røntgendata udvælger vigtige katalytiske egenskaberDette skema viser, hvordan spektre afledt af teoriberegninger ved hjælp af kendte strukturer (øverst) kan bruges til at træne et neuralt netværk (i midten), som så kan bruge sin samlede viden til at o -
 Små broer hjælper partikler med at holde sammenKredit:CC0 Public Domain Det sker uden for dit vindue, hver gang det regner:Jorden bliver våd og kan danne klistret mudder. Så tørrer det. Senere kan det regne igen. Hver befugtning og genfugtning
Små broer hjælper partikler med at holde sammenKredit:CC0 Public Domain Det sker uden for dit vindue, hver gang det regner:Jorden bliver våd og kan danne klistret mudder. Så tørrer det. Senere kan det regne igen. Hver befugtning og genfugtning -
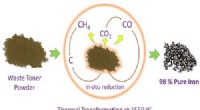 Træk jern ud af spildprintertonerKredit:American Chemical Society En skønne dag, rester af toner i kasserede printerpatroner kan have et nyt liv som bro eller bygningsdele i stedet for som skraldespand, spilde væk på lossepladser
Træk jern ud af spildprintertonerKredit:American Chemical Society En skønne dag, rester af toner i kasserede printerpatroner kan have et nyt liv som bro eller bygningsdele i stedet for som skraldespand, spilde væk på lossepladser


