Hvilken ville have et lavere kogepunkt NaCl eller SCL2?
Her er hvorfor:
* NaCl (natriumchlorid) er en ionisk forbindelse. De stærke elektrostatiske kræfter mellem de positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-) skaber en meget stærk krystalgitterstruktur. For at koge NaCl skal du overvinde disse stærke ioniske bindinger, der kræver en masse energi og resulterer i et højt kogepunkt (1465 ° C).
* SCL2 (svovldichlorid) er en kovalent forbindelse. Bindingerne mellem svovl og klor er svagere end de ioniske bindinger i NaCl. SCL2-molekyler har også svagere intermolekylære kræfter (dipol-dipol-interaktioner) sammenlignet med de stærke ioniske kræfter i NaCI. Dette betyder, at der er behov for mindre energi for at adskille SCL2-molekylerne, hvilket fører til et lavere kogepunkt (-78 ° C).
Kortfattet: Typen af binding og styrken af intermolekylære kræfter spiller en afgørende rolle i bestemmelsen af et stofs kogepunkt. Ioniske forbindelser som NaCl har meget højere kogepunkter end kovalente forbindelser som SCL2.
 Varme artikler
Varme artikler
-
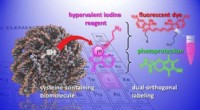 Nye kemiske værktøjer til at modificere og studere biomolekylerEn illustration af den kemiske reaktion udviklet i undersøgelsen. Kredit:J. Waser/B. Fierz (EPFL) Forståelse af strukturen og metabolismen af celler og levende organismer er afgørende for udvikl
Nye kemiske værktøjer til at modificere og studere biomolekylerEn illustration af den kemiske reaktion udviklet i undersøgelsen. Kredit:J. Waser/B. Fierz (EPFL) Forståelse af strukturen og metabolismen af celler og levende organismer er afgørende for udvikl -
 Ny superlim gør det muligt at binde strækbare hydrogelerEn hydrogel elektronisk hud båret på et menneskeligt håndled med kontinuerlig kontrol og datalogning via en mobiltelefon. Hydrogel smart skin består af en fleksibel og genanvendelig enhed med strømfor
Ny superlim gør det muligt at binde strækbare hydrogelerEn hydrogel elektronisk hud båret på et menneskeligt håndled med kontinuerlig kontrol og datalogning via en mobiltelefon. Hydrogel smart skin består af en fleksibel og genanvendelig enhed med strømfor -
 Graphen-omviklede zeolitmembraner til hurtig hydrogenseparationFigur 1. Transmissionselektronmikrofotografi af grafenindpakket zeolit. Kredit:Forfatterne Effekterne af den globale opvarmning bliver mere alvorlige, og der er en stærk efterspørgsel efter teknolo
Graphen-omviklede zeolitmembraner til hurtig hydrogenseparationFigur 1. Transmissionselektronmikrofotografi af grafenindpakket zeolit. Kredit:Forfatterne Effekterne af den globale opvarmning bliver mere alvorlige, og der er en stærk efterspørgsel efter teknolo -
 Team opdager kontrol af cellesignalering ved hjælp af et kobolt (III) -nitrosylkompleksProfessor Jaeheung Cho (forrest til venstre) - Professor Daeha Seo (foran til højre), og forskerteam i Institut for Emerging Materials Science. Kredit:DGIST To professorers fælles forskerhold har
Team opdager kontrol af cellesignalering ved hjælp af et kobolt (III) -nitrosylkompleksProfessor Jaeheung Cho (forrest til venstre) - Professor Daeha Seo (foran til højre), og forskerteam i Institut for Emerging Materials Science. Kredit:DGIST To professorers fælles forskerhold har


