Hvordan ser en generel syrebasreaktion ud?
ha + b ⇌ a⁻ + hb⁺
Hvor:
* ha er syre , der donerer en proton (H⁺).
* b er basen , der accepterer protonen.
* a⁻ er konjugatbasen af syren.
* hb⁺ er konjugatsyre af basen.
Forklaring:
* syre (ha) :En syre er et stof, der kan donere en proton (H⁺). I reaktionen mister Ha en proton for at danne sin konjugatbase a⁻.
* base (b) :En base er et stof, der kan acceptere en proton (H⁺). I reaktionen får B en proton fra syren for at danne dens konjugerede syre Hb⁺.
Vigtige punkter:
* Reaktionen er en ligevægtsreaktion , hvilket betyder, at det kan fortsætte i både fremadgående og omvendte retninger.
* Styrken af syren og basen bestemmer ligevægtens placering. Stærkere syrer donerer protoner lettere, mens stærkere baser accepterer protoner lettere.
* konjugatsyre-basepar er altid på modsatte sider af ligevægten.
Eksempler på generelle syre-base-reaktioner:
* hcl (syre) + H₂O (base) ⇌ cl⁻ (konjugeret base) + h₃o⁺ (konjugatsyre)
* ch₃cooh (syre) + nh₃ (base) ⇌ ch₃coo⁻ (konjugatbase) + nh₄⁺ (konjugatsyre)
Bemærk:
* Den generelle syre-base-reaktion er en bred definition Det inkluderer forskellige syre-base-teorier som Brønsted-Lowry Theory og Lewis Theory.
* Den specifikke form for reaktionen kan variere afhængigt af den specifikke syre og den involverede base.
 Varme artikler
Varme artikler
-
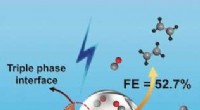 Elektroreduktion af kulilte til den meget selektive produktion af ethylenKredit:Angewandte Chemie Ethylen, eller ethene, er et primært råstof til den kemiske industri, herunder som udgangsmateriale til fremstilling af en lang række plastmaterialer. I journalen Angewan
Elektroreduktion af kulilte til den meget selektive produktion af ethylenKredit:Angewandte Chemie Ethylen, eller ethene, er et primært råstof til den kemiske industri, herunder som udgangsmateriale til fremstilling af en lang række plastmaterialer. I journalen Angewan -
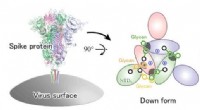 Glykaner er afgørende for COVID-19-infektionMolekylær mekanisme, der ligger til grund for den strukturelle ændring af SARS-CoV-2 spike-proteinet. Kredit:RIKEN En forskergruppe ved RIKEN Center for Computational Science (R-CCS) har fundet ud
Glykaner er afgørende for COVID-19-infektionMolekylær mekanisme, der ligger til grund for den strukturelle ændring af SARS-CoV-2 spike-proteinet. Kredit:RIKEN En forskergruppe ved RIKEN Center for Computational Science (R-CCS) har fundet ud -
 C. elegans rundorme høster et vigtigt coenzym fra de bakterier, de indtagerCaenorhabditis elegans. Kredit:Wikipedia En undersøgelse udført i C. elegans nematode rundorm kan føre til forbedret behandling af en sjælden menneskelig genetisk lidelse, der forårsager alvorli
C. elegans rundorme høster et vigtigt coenzym fra de bakterier, de indtagerCaenorhabditis elegans. Kredit:Wikipedia En undersøgelse udført i C. elegans nematode rundorm kan føre til forbedret behandling af en sjælden menneskelig genetisk lidelse, der forårsager alvorli -
 Hvordan muslinger laver en kraftig undervandslimMuslingernes skæg (som kogene fjerner, før de tilberedes) består af byssaltråde og bruges til at hjælpe med at holde muslingerne bundet på plads. For enden af hver tråd er en skiveformet plak, der f
Hvordan muslinger laver en kraftig undervandslimMuslingernes skæg (som kogene fjerner, før de tilberedes) består af byssaltråde og bruges til at hjælpe med at holde muslingerne bundet på plads. For enden af hver tråd er en skiveformet plak, der f
- Gendannelse af den amerikanske kastanje ved at undersøge dens genom
- Hvem var de to mænd, der faldt ned til dybden af syv miles i Bathyscaph Trieste?
- Gablus klarer sig meget dårligere, hvilket forårsager større klimapåvirkning:undersøgelse
- Team udvikler kemisk løsning til grafenudfordringer
- Konvergent udvikling af mimetiske sommerfugle forvirrer klassificering
- Luftforurening


