Hvordan adskiller en polariseret anion sig fra en upolariseret anion?
Sådan kan vi fortolke forskellen:
polariseret anion:
* Definition: En anion, der har en ujævn fordeling af elektrondensitet, hvilket resulterer i et midlertidigt eller permanent dipolmoment.
* Årsager til polarisering:
* Elektronegativitetsforskel: Hvis en anion er bundet til et stærkt elektronegativt atom (som ilt), trækkes elektronerne i bindingen mod det elektronegative atom, hvilket skaber en delvis negativ ladning på dette atom og en delvis positiv ladning på anionen.
* stor størrelse og høj opladningstæthed: Anioner med stor størrelse og høj ladningstæthed (som iodid, I-) er lettere polariseret på grund af den større fordeling af deres elektronsky.
* Konsekvenser af polarisering:
* Øget reaktivitet: Polariserede anioner er mere reaktive, fordi den delvise positive ladning kan tiltrække nukleofiler eller elektrofiler.
* Ændrede bindingsvinkler og former: Polarisering kan påvirke bindingsvinklerne og den samlede form af et molekyle indeholdende den polariserede anion.
Unpolariseret anion:
* Definition: En anion med en jævn fordeling af elektrondensitet, der mangler et betydeligt dipolmoment.
* Årsager til upolarisering:
* Lille størrelse og lav opladningstæthed: Anioner med lille størrelse og lav ladetæthed (som fluor, F-) er mindre let polariserede.
* binding med mindre elektronegative atomer: Anioner, der er bundet til mindre elektronegative atomer, vil opleve mindre elektron -tilbagetrækning og forbliver derfor mindre polariseret.
* konsekvenser af upolarisering:
* lavere reaktivitet: Upolariserede anioner er generelt mindre reaktive sammenlignet med deres polariserede kolleger.
* mindre indflydelse på obligationsvinkler: Manglen på et signifikant dipolmoment betyder, at de har minimal indflydelse på den samlede molekylære form.
Eksempler:
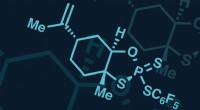
* polariseret: Anionen i en carbonylgruppe (C =O) er polariseret på grund af den høje elektronegativitet af ilt.
* upolariseret: Fluoridanionen (F-) er relativt upolariseret på grund af dens lille størrelse og lave ladningstæthed.
Kortfattet:
Forskellen mellem en polariseret anion og en upolariseret anion ligger i fordelingen af elektrondensitet. Polarisering fører til et midlertidigt eller permanent dipolmoment, hvilket påvirker anionens reaktivitet, form og interaktioner med andre molekyler. Upolariserede anioner mangler denne ujævne fordeling og er generelt mindre reaktive og har minimal indflydelse på molekylær form.
Sidste artikelHvor mange joules har en liter olie?
Næste artikelHvad får ph til at gå op og ned?
 Varme artikler
Varme artikler
-
 Forskere skaber atomlimpistol for at bygge bedre nukleinsyreterapiKredit:Scripps Research Institute Når det kommer til visse molekyler, form gør hele forskellen. Formen af limonen, for eksempel, en forbindelse fremstillet af citrusfrugter, bestemmer, om det sm
Forskere skaber atomlimpistol for at bygge bedre nukleinsyreterapiKredit:Scripps Research Institute Når det kommer til visse molekyler, form gør hele forskellen. Formen af limonen, for eksempel, en forbindelse fremstillet af citrusfrugter, bestemmer, om det sm -
 3-D-printede væv kan holde atleter i aktionRice University-studerende Sean Bittner har en prøve af et 3D-printet stillads, der en dag kan hjælpe med at helbrede osteochondrale skader af den slags, som atleter ofte lider af. Materialet efterlig
3-D-printede væv kan holde atleter i aktionRice University-studerende Sean Bittner har en prøve af et 3D-printet stillads, der en dag kan hjælpe med at helbrede osteochondrale skader af den slags, som atleter ofte lider af. Materialet efterlig -
 En kunstig tunge af guld til at smage ahornsirupKredit:University of Montreal Det siges, at ahornsirup er Quebecs flydende guld. Nu har forskere ved Université de Montréal fundet en måde at bruge ægte guld – i form af nanopartikler – for hurtig
En kunstig tunge af guld til at smage ahornsirupKredit:University of Montreal Det siges, at ahornsirup er Quebecs flydende guld. Nu har forskere ved Université de Montréal fundet en måde at bruge ægte guld – i form af nanopartikler – for hurtig -
 Et opløseligt smartwatch gør det nemmere at genbruge elektronikEt prototype smartwatch lavet med zink-sølv nanokomposit-kredsløb inde i en poly(vinylalkohol) kasse (øverst) opløses i vand inden for 40 timer (nederst). Kredit:Tilpasset fra ACS Applied Materials &I
Et opløseligt smartwatch gør det nemmere at genbruge elektronikEt prototype smartwatch lavet med zink-sølv nanokomposit-kredsløb inde i en poly(vinylalkohol) kasse (øverst) opløses i vand inden for 40 timer (nederst). Kredit:Tilpasset fra ACS Applied Materials &I
- Forskere udvikler en miljøvenlig magnet til at bekæmpe mikroplastik
- Brændselsceller viser potentiale
- Forskere udvikler fagocytiske protoceller, der er i stand til målrettet levering af enzymer
- Lander på livets oprindelse
- Et videnskabsprojekt om magnetiske biler
- En ny metode til at synkronisere enheder på Jorden gør brug af kosmiske stråler


