Hvilket volumen ville blive besat af 2 mol propangas C3H8 ved standardbetingelser?
forståelse af koncepterne
* Standardbetingelser (STP): Standard temperatur og tryk defineres som 0 ° C (273,15 K) og 1 atm -tryk.
* Ideel gaslov: Den ideelle gaslov siger, at PV =NRT, hvor:
* P =pres (i ATM)
* V =volumen (i liter)
* n =antal mol
* R =ideel gaskonstant (0,0821 l · atm/mol · k)
* T =temperatur (i Kelvin)
Beregning
1. Identificer de kendte værdier:
* n =2 mol
* P =1 atm
* T =273,15 K
* R =0,0821 l · atm/mol · k
2. Omarranger den ideelle gaslov, der skal løses for volumen (v):
V =(nrt) / p
3. erstatte værdierne og løse:
V =(2 mol * 0,0821 L · ATM / Mol · K * 273,15 K) / 1 atm
V =44,8 L
Derfor ville 2 mol propangas besætte et volumen på 44,8 liter ved standardbetingelser.
 Varme artikler
Varme artikler
-
 Et molekylært kig på begyndende HDL-dannelseForskere ved Boston University brugte en trunkeret version af Apolipoprotein A-I, vist her, at fastslå endegyldigt, at proteinet skal bindes til lipidtransportøren ABCA1 for at begynde at danne high-d
Et molekylært kig på begyndende HDL-dannelseForskere ved Boston University brugte en trunkeret version af Apolipoprotein A-I, vist her, at fastslå endegyldigt, at proteinet skal bindes til lipidtransportøren ABCA1 for at begynde at danne high-d -
 Forskere udvikler værktøj til hurtig diagnosticering af bakterielle infektionerMohammad Zarifi, en assisterende professor ved UBC Okanagan, viser sin lille biosensor, der kan bruges til at stille en realtidsdiagnose af en bakteriel infektion. Kredit:UBC Okanagan Ved hjælp af
Forskere udvikler værktøj til hurtig diagnosticering af bakterielle infektionerMohammad Zarifi, en assisterende professor ved UBC Okanagan, viser sin lille biosensor, der kan bruges til at stille en realtidsdiagnose af en bakteriel infektion. Kredit:UBC Okanagan Ved hjælp af -
 Materialeforskere skaber stærkere kobolt til brændselscellerKredit:Pacific Northwest National Laboratory Et multiinstitutionelt forskerteam ledet af materialeforskere fra Pacific Northwest National Laboratory (PNNL) har designet en yderst aktiv og holdbar
Materialeforskere skaber stærkere kobolt til brændselscellerKredit:Pacific Northwest National Laboratory Et multiinstitutionelt forskerteam ledet af materialeforskere fra Pacific Northwest National Laboratory (PNNL) har designet en yderst aktiv og holdbar -
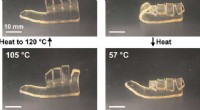 Tuning af frontal polymerisering til forskellige materialegenskaberBillederne illustrerer ændringen i polymerform afhængigt af glasovergangstemperaturen. Kredit:Autonomous Materials Systems Group. Forskere fra University of Illinois i Urbana-Champaign har forbedr
Tuning af frontal polymerisering til forskellige materialegenskaberBillederne illustrerer ændringen i polymerform afhængigt af glasovergangstemperaturen. Kredit:Autonomous Materials Systems Group. Forskere fra University of Illinois i Urbana-Champaign har forbedr
- Omarrangering af lagene i solcellemoduler kan hjælpe med at forbedre effektiviteten
- Sådan beregnes fraktioner til procentdele
- En vej mod rent drikkevand for alle californiere
- Mulighed eller drøm:Hvor tæt er vi på at se flyvende biler?
- Hvor mange atomer er der i NaHCO3?
- Hvor ensartet cirkulær bevægelse belønnes fra accelereret bevægelse?


