Hvad er pH på 150000 l en opløsning, der indeholder 45 gram salpetersyre og 998 hydrobrominsyre?
* HBR (hydrobrominsyre) er en stærk syre: Det adskiller sig fuldstændigt i vand, hvilket betyder, at det frigiver alle sine brintioner (H+). Dette gør det til en meget stærk syre.
* måleenheder: 998 henviser sandsynligvis til antallet af molekyler af HBR, hvilket ikke er en nyttig enhed til beregning af pH. Vi har brug for enten:
* mol: Antallet af mol HBR til stede.
* Molaritet: Koncentrationen af HBR i mol pr. Liter (mol/L).
Her er hvordan man beregner pH i en opløsning med kendte mængder:
1. Beregn antallet af mol af hver syre:
* Mol Hno₃ =(masse af Hno₃) / (molmasse Hno₃) =45 g / 63,01 g / mol ≈ 0,714 mol
* Du skal tilvejebringe massen af HBR for at beregne dens mol.
2. Beregn den samlede koncentration af H+ -ioner:
* Både HNO₃ og HBR er stærke syrer, så de bidrager med alle deres H+ -ioner til opløsningen.
* [H +] =(mol Hno₃ + mol HBR) / (Total mængde opløsning)
* Du har brug for mængden af opløsningen i liter (150000 L i dette tilfælde).
3. Beregn pH:
* ph =-log [H+]
Eksempel:
Lad os sige, at du har 100 gram HBR.
1. mol HBR:
* Mol HBR =(masse af HBR) / (molmasse HBR) =100 g / 80,91 g / mol ≈ 1,237 mol
2. Total koncentration af H+ -ioner:
* [H +] =(0,714 mol + 1,237 mol) / 150000 l ≈ 1,30 x 10^-5 mol / l
3. ph:
* ph =-log (1,30 x 10^-5) ≈ 4,89
Angiv massen af HBR i gram for at få en nøjagtig pH -beregning.
 Varme artikler
Varme artikler
-
 Protein afledt af havre bindes til celle-selvmordsenzym i ny teknikKredit:CC0 Public Domain Evnen til selektivt at udrydde bestemte celletyper fra flercellede organismer gør det muligt for forskere at dechiffrere disse cellers funktioner, men de tilgængelige værk
Protein afledt af havre bindes til celle-selvmordsenzym i ny teknikKredit:CC0 Public Domain Evnen til selektivt at udrydde bestemte celletyper fra flercellede organismer gør det muligt for forskere at dechiffrere disse cellers funktioner, men de tilgængelige værk -
 Bygge broer med vandmolekylerVandmolekyler danner komplekse strukturer på en jernoxidoverflade. Kredit:Vienna University of Technology Et hold ved TU Wien har nu beviset bag spekulationerne om, at vandmolekyler kan danne komp
Bygge broer med vandmolekylerVandmolekyler danner komplekse strukturer på en jernoxidoverflade. Kredit:Vienna University of Technology Et hold ved TU Wien har nu beviset bag spekulationerne om, at vandmolekyler kan danne komp -
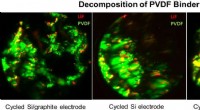 Mod omkostningseffektive løsninger til næste generations forbrugerelektronik, elbiler og elnetNedbrydningen af et polyvinylidenfluorid (PVDF) bindemiddel i et højenergibatteri. Kredit:Jigang Zhou Jagten på et bedre lithium-ion-batteri - et, der kunne holde en mobiltelefon i gang i dagevi
Mod omkostningseffektive løsninger til næste generations forbrugerelektronik, elbiler og elnetNedbrydningen af et polyvinylidenfluorid (PVDF) bindemiddel i et højenergibatteri. Kredit:Jigang Zhou Jagten på et bedre lithium-ion-batteri - et, der kunne holde en mobiltelefon i gang i dagevi -
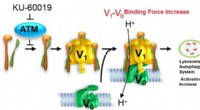 Forskere rapporterer hæmning af cellulær aldringOpdag nøglen til at afsløre hemmeligheden bag reversibel aldringsopsving. Kredit:DGIST Aldring er en forringelse af en celles evne til at dele sig og vokse, når den bliver ældre. Dette forårsager
Forskere rapporterer hæmning af cellulær aldringOpdag nøglen til at afsløre hemmeligheden bag reversibel aldringsopsving. Kredit:DGIST Aldring er en forringelse af en celles evne til at dele sig og vokse, når den bliver ældre. Dette forårsager
- Arbejdsudnyttelse er endemisk i globale te- og kakaoindustrier, internationale undersøgelser finder
- Fysikere udvikler skalerbar metode til fremstilling af grafen
- Sådan beregnes w /v (vægt efter volumen)
- Kemikere observerer uhyggelig kvantetunnelering
- Beetles of Washington
- Seniorer vil gerne vide, hvem de kan stole på online


