Hvordan er partikler arrangeret i et fast metal?
* Luk pakning: Atomer i metaller er tæt pakket sammen, hvilket maksimerer antallet af atomer, der kan passe ind i et givet rum. Dette fører til høj densitet og styrke.
* Regelmæssig arrangement: Atomer er arrangeret i et gentagende mønster, der danner en krystalgitter . Almindelige krystalstrukturer for metaller inkluderer ansigtscentreret kubisk (FCC), kropscentreret kubisk (BCC) og hexagonal tætpakket (HCP).
* Metallisk binding: Atomerne holdes sammen af metallisk binding , som involverer deling af delokaliserede elektroner. Disse elektroner kan bevæge sig frit gennem metallet og danne et "hav" af elektroner, der omgiver de positivt ladede atomkerner. Denne frie bevægelighed af elektroner er ansvarlig for mange af egenskaberne ved metaller, såsom konduktivitet og formbarhed.
Her er en visuel analogi: Forestil dig en kasse fuld af perfekt passende kugler. Marmoren repræsenterer atomerne, og den måde, de passer sammen på, repræsenterer krystalgitteret. Rummet mellem kuglerne repræsenterer "havet" af elektroner, der kan bevæge sig frit mellem atomerne.
Nøgleegenskaber ved metalstruktur:
* Høj densitet: På grund af tæt pakning af atomer
* høje smelte- og kogepunkter: Stærk metallisk binding kræver betydelig energi for at bryde
* gode ledere af varme og elektricitet: Frie bevægelse af elektroner giver mulighed for let overførsel af energi
* formbar og duktil: Det almindelige arrangement af atomer giver dem mulighed for at glide forbi hinanden uden at bryde strukturen
* skinnende: De frie elektroner reflekterer lys og giver metaller deres skinnende udseende
Bemærk: Mens de fleste metaller danner krystallinske strukturer, kan nogle metaller have amorfe strukturer, hvor atomerne er arrangeret tilfældigt. Dette er dog mindre almindelige.
Sidste artikelHvad er de tre mest almindelige subatomære partikler?
Næste artikelMolekyler pakkes tættere ind?
 Varme artikler
Varme artikler
-
 Ny miljøvenlig elektrokemisk reaktion kan syntetisere nyttige halvledermaterialerElektrokemisk opsætning til syntese af thienoacenderivater. Kredit:Okayama University 2020 Organiske solceller har en række anvendelser inden for elektronik, især i udviklingen af nye elektronis
Ny miljøvenlig elektrokemisk reaktion kan syntetisere nyttige halvledermaterialerElektrokemisk opsætning til syntese af thienoacenderivater. Kredit:Okayama University 2020 Organiske solceller har en række anvendelser inden for elektronik, især i udviklingen af nye elektronis -
 En superopløsningsvisning af kemiske reaktionerDen nye metode til dataanalyse fra superopløsningsfluorescenskorrelationsmikroskopi er blevet verificeret, blandt andre, i forsøg, der efterligner det biologiske miljø. Forskere observerede små fluore
En superopløsningsvisning af kemiske reaktionerDen nye metode til dataanalyse fra superopløsningsfluorescenskorrelationsmikroskopi er blevet verificeret, blandt andre, i forsøg, der efterligner det biologiske miljø. Forskere observerede små fluore -
 Video:Hvorfor lugter månen af krudt?Kredit:The American Chemical Society Efter at have gået på månen, astronauter hoppede tilbage i deres månelander, bringer himmellegemets støv med sig på deres rumdragter. De var overraskede, og f
Video:Hvorfor lugter månen af krudt?Kredit:The American Chemical Society Efter at have gået på månen, astronauter hoppede tilbage i deres månelander, bringer himmellegemets støv med sig på deres rumdragter. De var overraskede, og f -
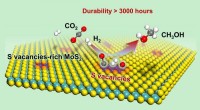 Katalytisk hydrogenering af kuldioxid til methanolForskere opnåede for første gang lavtemperatur højeffektiv hydrogenering af CO2 til methanol, med et langt arbejdsliv over svovlfri stillingsrige fålags MoS2, samt bemærkelsesværdigt højere aktivitet
Katalytisk hydrogenering af kuldioxid til methanolForskere opnåede for første gang lavtemperatur højeffektiv hydrogenering af CO2 til methanol, med et langt arbejdsliv over svovlfri stillingsrige fålags MoS2, samt bemærkelsesværdigt højere aktivitet
- Pulserne stiger, da ny undersøgelse afslører plantens hemmeligheder, der holder folk i ro
- Hvad gør rødalger så forskellige, og hvorfor skulle vi bekymre os?
- Producerer en kemisk ændring altid varme?
- Hvordan påvirker elevation land?
- Accelererende opdagelse af elektrokatalysatorer med maskinlæring
- Undersøgelse finder den mest sandsynlige vej for de første mennesker til Australien


