Hvorfor er dipolmoment nul i ikke -polære molekyler molekyler?
Forståelse af dipolmomenter
* polære obligationer: En polær binding dannes, når to atomer med signifikant forskellige elektronegativiteter deler elektroner. Det mere elektronegative atom tiltrækker de delte elektroner stærkere og skaber en delvis negativ ladning (Δ-) nær det og en delvis positiv ladning (Δ+) nær det mindre elektronegative atom.
* dipolmoment: Et dipolmoment er et mål for adskillelse af positive og negative ladninger inden for et molekyle. Det er repræsenteret af en vektor, der peger fra den positive til den negative ende. Størrelsen af dipolmomentet afhænger af forskellen i elektronegativitet mellem atomerne og afstanden mellem ladningerne.
Hvorfor ikke -polære molekyler har nul dipolmomenter
1. symmetrisk struktur: Ikke -polære molekyler har et symmetrisk arrangement af atomer. Denne symmetri sikrer, at de individuelle bindingsdipoler (på grund af polære bindinger) annullerer hinanden.
2. Lige og modsatte afgifter: Fordelingen af elektrondensitet er ensartet i hele molekylet. Selv hvis individuelle obligationer har en vis polaritet, neutraliserer de modstående ladninger inden for molekylet effektivt hinanden.
Eksempler
* CO2: Kuldioxid (CO2) har to polære C =O -bindinger, men molekylet er lineært og symmetrisk. De to bindingsdipoler er lige i størrelse, men modsat i retning, så de annullerer hinanden.
* CH4: Methan (CH4) har fire C-H-bindinger, som er let polære. Imidlertid sikrer den tetrahedrale form af molekylet, at bindoledipolerne annullerer.
* n2: Kvælstofgas (N2) har en tredobbelt binding mellem nitrogenatomerne. Da begge nitrogenatomer har den samme elektronegativitet, er bindingen ikke -polær, og molekylet har nul dipolmoment.
Kortfattet:
* Ikke -polære molekyler har enten ingen polære bindinger eller har polære bindinger, der er arrangeret på en måde, som deres dipolmomenter annullerer.
* Denne symmetri og afbalancerede ladningsfordeling resulterer i et nul samlet dipolmoment for molekylet.
Sidste artikelHvad skal pH -værdien opløses noget?
Næste artikelEr en orange dårlig eller god dirigent?
 Varme artikler
Varme artikler
-
 3-D printede elektroder frigør gassenArkitekterede 3-D elektroder:Håndtering af boblemigrering i gasudviklingsreaktioner ved høje strømtætheder. Kredit:Yat Li. Alkalisk vandelektrolyse er blevet udråbt som en vej til at etablere en b
3-D printede elektroder frigør gassenArkitekterede 3-D elektroder:Håndtering af boblemigrering i gasudviklingsreaktioner ved høje strømtætheder. Kredit:Yat Li. Alkalisk vandelektrolyse er blevet udråbt som en vej til at etablere en b -
 Video:Hvorfor er vestkysten himmelorange?Kredit:The American Chemical Society Californiens skovbrande er, desværre, intet nyt - men det er den lyse orange himmel bestemt. Denne uge om reaktioner, vi taler med eksperter, der forklarer år
Video:Hvorfor er vestkysten himmelorange?Kredit:The American Chemical Society Californiens skovbrande er, desværre, intet nyt - men det er den lyse orange himmel bestemt. Denne uge om reaktioner, vi taler med eksperter, der forklarer år -
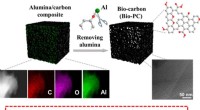 Grænseflade-induceret fremstilling af porøst kulstof med forbedrede iboende aktive stederUnder ikke-oxidationsbetingelser blev in-situ dannet aluminiumoxid/carbon-grænseflade udviklet som en vugge til generering af tilgængelige aktive steder. Det kan også justere den porøse struktur af re
Grænseflade-induceret fremstilling af porøst kulstof med forbedrede iboende aktive stederUnder ikke-oxidationsbetingelser blev in-situ dannet aluminiumoxid/carbon-grænseflade udviklet som en vugge til generering af tilgængelige aktive steder. Det kan også justere den porøse struktur af re -
 Hvordan molekyler sidder på overflader driver energi og elektronoverførselKredit:Pixabay/CC0 Public Domain Florida State University -forskere, der ønsker at gøre nyere, mere energieffektive materialer har gjort et gennembrud i forståelsen af, hvordan struktur dikterer e
Hvordan molekyler sidder på overflader driver energi og elektronoverførselKredit:Pixabay/CC0 Public Domain Florida State University -forskere, der ønsker at gøre nyere, mere energieffektive materialer har gjort et gennembrud i forståelsen af, hvordan struktur dikterer e
- Bakteriers elektriske egenskaber:Hvordan membranpotentiale påvirker antibiotikatolerance
- Ørkenprøvetur for Mars rover styret fra 1, 000 miles væk
- Et tal foran en kemisk formel en ligning, der angiver, hvor mange molekyler eller atomer hver reakta…
- Effekten af temperatur på enzymaktivitet og biologi
- Hvilke landformer kan en tornado skabe på jorden?
- Forskere producerer det bedste skøn over Jordens sammensætning


