Hvad skal pH -værdien opløses noget?
* ph og opløselighed: PH påvirker primært * -hastigheden * ved opløsning og den * omfang *, som et stof opløses. Det er ikke en direkte "on-off" switch.
* Kemiske egenskaber: Opløseligheden af et stof afhænger meget af dets kemiske egenskaber:
* syrer: Syrer opløses lettere i alkaliske (basale) opløsninger.
* baser: Baser opløses lettere i sure opløsninger.
* salte: Nogle salte opløses bedre i sure opløsninger, nogle i basale opløsninger, og andre er relativt upåvirket af pH.
* specifikke eksempler:
* calciumcarbonat (CACO3): Dette er hovedkomponenten i kalksten og opløses lettere i sure opløsninger.
* magnesiumhydroxid (Mg (OH) 2): Dette er en base og opløses lettere i sure opløsninger.
* natriumchlorid (NaCl): Bordsalt opløses godt i både sure og basale opløsninger, skønt det er mere opløseligt i vand med en neutral pH (ca. 7).
Nøglepunkter:
* ph ændrer kemiske reaktioner: Opløsningsprocessen involverer ofte kemiske reaktioner. PH kan påvirke disse reaktioner ved at påvirke koncentrationerne af ioner (H+ og OH-) i opløsningen.
* opløselighed vs. opløsning: Et stof kan være opløseligt i et bestemt opløsningsmiddel, men opløsningshastigheden (hvor hurtigt det opløses) kan være langsomt.
I stedet for at spørge "hvilken pH er nødvendig for at opløse noget?" Du spørger måske:
* "Hvordan påvirker PH opløseligheden af [stof]?"
* "Hvilket pH -område er optimalt til at opløse [stof]?"
For at få et præcist svar skal du kende det specifikke stof, du har at gøre med, og overveje dets kemiske egenskaber.
 Varme artikler
Varme artikler
-
 Kemikere lærer et enzym et nyt trick, med potentiale til at bygge nye molekylerTodd Hysters forskergruppe ved Princeton University har fundet en måde at få et naturligt forekommende enzym til at antage et nyt, kunstig rolle. Fra venstre:David Miller, postdoktor; Kyle Biegasiewic
Kemikere lærer et enzym et nyt trick, med potentiale til at bygge nye molekylerTodd Hysters forskergruppe ved Princeton University har fundet en måde at få et naturligt forekommende enzym til at antage et nyt, kunstig rolle. Fra venstre:David Miller, postdoktor; Kyle Biegasiewic -
 Optisk påvisning af flere bakteriearter ved hjælp af metal-organiske hybrider i nanometerskalaGrafisk abstrakt. Kredit:Analytisk kemi (2022). DOI:10.1021/acs.analchem.2c01188 Forskere fra Osaka Metropolitan University har udviklet en enkel, hurtig metode til samtidigt at identificere flere
Optisk påvisning af flere bakteriearter ved hjælp af metal-organiske hybrider i nanometerskalaGrafisk abstrakt. Kredit:Analytisk kemi (2022). DOI:10.1021/acs.analchem.2c01188 Forskere fra Osaka Metropolitan University har udviklet en enkel, hurtig metode til samtidigt at identificere flere -
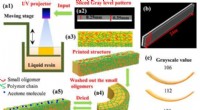 4-D-print, vendbare formændrende materialer med lysbaseret gråtonemønsterGråskala 4D-printmetoden a1) skemaer af metoden med digital lysbehandling (DLP), a2) repræsentativt gråtonemønster til udskrivning, a3) diagrammer af en trykt struktur med forskellig tværbindingstæthe
4-D-print, vendbare formændrende materialer med lysbaseret gråtonemønsterGråskala 4D-printmetoden a1) skemaer af metoden med digital lysbehandling (DLP), a2) repræsentativt gråtonemønster til udskrivning, a3) diagrammer af en trykt struktur med forskellig tværbindingstæthe -
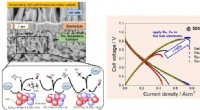 Forskere udvikler højtydende keramisk brændselscelle, der fungerer på butangasNår nikkelkatalysatoren i keramiske brændselsceller bruges sammen med kulbrintebrændstoffer, såsom metan, propan, og butan, det kulstof, der dannes under brændstofomdannelsen, aflejres på overfladen a
Forskere udvikler højtydende keramisk brændselscelle, der fungerer på butangasNår nikkelkatalysatoren i keramiske brændselsceller bruges sammen med kulbrintebrændstoffer, såsom metan, propan, og butan, det kulstof, der dannes under brændstofomdannelsen, aflejres på overfladen a


