Hvordan dannes kulsyre?
Her er den kemiske ligning:
co₂ + h₂o ⇌ h₂co₃
Denne reaktion er reversibel , hvilket betyder, at det kan fortsætte i begge retninger. Under normale forhold ligger ligevægten imidlertid stærkt for venstre , hvilket betyder, at der er meget mere opløst CO₂ end kulsyre i opløsning.
Her er en sammenbrud af processen:
1. co₂ opløses i vand: Når co₂ kommer i kontakt med vand, opløses det i væsken.
2. Hydrering: Når den er opløst, reagerer CO₂ med vandmolekyler til dannelse af kulsyre.
3. ligevægt: Reaktionen når ligevægt, hvor dannelseshastigheden af kulsyre er lig med hastigheden for dens nedbrydning tilbage til co₂ og vand.
Faktorer, der påvirker dannelse af kulsyre:
* tryk: Højere tryk favoriserer dannelsen af kulsyre.
* Temperatur: Lavere temperaturer favoriserer dannelsen af kulsyre.
* ph: Lavere pH (mere surt) favoriserer dannelsen af kulsyre.
Betydningen af kulsyre:
Kulsyre spiller en afgørende rolle i forskellige biologiske og geologiske processer, herunder:
* blodbuffering: Det hjælper med at regulere blodets pH.
* forsuring af hav: Absorptionen af atmosfærisk co₂ i havet danner kulsyre, hvilket bidrager til forsuring af havet.
* carbonat mineraldannelse: Kulsyre reagerer med mineraler for at danne carbonatklipper som kalksten.
Det er vigtigt at bemærke, at kulsyre er en svag syre , hvilket betyder, at det kun delvist ioniserer i opløsningen. Dette betyder, at det ikke let frigiver hydrogenioner (H⁺), hvilket gør det mindre ætsende end stærke syrer som saltsyre (HCI).
 Varme artikler
Varme artikler
-
 Microgel-pulver bekæmper infektioner og hjælper med at hele sårMicrogel Powder:Sticky catechol laver hydrogenperoxid; Sikker og tør:Opbevaring af flydende brintoverilte kan være farligt, inert pulver er mere bærbart; Neutral pH:Tilsætning af en let bufret opløsni
Microgel-pulver bekæmper infektioner og hjælper med at hele sårMicrogel Powder:Sticky catechol laver hydrogenperoxid; Sikker og tør:Opbevaring af flydende brintoverilte kan være farligt, inert pulver er mere bærbart; Neutral pH:Tilsætning af en let bufret opløsni -
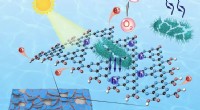 Forskere udvikler metalfri fotokatalysator til at rense patogenrigt vand på få minutterDe elektronoptagende grupper blev selektivt indført på kanten af g-C3N4 nanosheets til en fotodesinfektion. Kredit:TENG Zhenyuan og YANG Nailiang Forskere rundt om i verden har ødelagt deres hje
Forskere udvikler metalfri fotokatalysator til at rense patogenrigt vand på få minutterDe elektronoptagende grupper blev selektivt indført på kanten af g-C3N4 nanosheets til en fotodesinfektion. Kredit:TENG Zhenyuan og YANG Nailiang Forskere rundt om i verden har ødelagt deres hje -
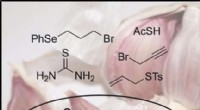 Kort total syntese af ajoene, en biologisk aktiv komponent i olieekstrakter af hvidløgKredit:Wiley Friske hvidløgsekstrakter indeholder en række sunde organiske svovlforbindelser, blandt hvilke ajoene udgør en vigtig olie-ekstraherbar ingrediens. Nu, kemikere i Det Forenede Kongeri
Kort total syntese af ajoene, en biologisk aktiv komponent i olieekstrakter af hvidløgKredit:Wiley Friske hvidløgsekstrakter indeholder en række sunde organiske svovlforbindelser, blandt hvilke ajoene udgør en vigtig olie-ekstraherbar ingrediens. Nu, kemikere i Det Forenede Kongeri -
 LSU Chemical Engineering afslører nye destillationskolonnerJohn Pendergast, professional-in-residence i Cain Department of Chemical Engineering, og John Flake, formand for Cain Department of Chemical Engineering. Kredit:LSU College of Engineering LSU Cain
LSU Chemical Engineering afslører nye destillationskolonnerJohn Pendergast, professional-in-residence i Cain Department of Chemical Engineering, og John Flake, formand for Cain Department of Chemical Engineering. Kredit:LSU College of Engineering LSU Cain
- Hvilken måleenhed er mest nyttig til en vægt?
- Hvad er forholdet mellem energi og frekvens af elektromagnetiske bølger i spektrum?
- Sammensatte farer udgør en øget risiko for højt befolkede regioner i Himalaya
- Team udvikler en ny måde at generere kraftfulde og fokuserede røntgenstråler ved hjælp af elektr…
- Tidligere ukendte dinosaurarter identificeret i det sydvestlige Tyskland
- Er 'diesel topmøde' sidste chance for Tysklands favoritmotor?


