Hvordan kontrasterer omdannelsen af vand til en gasformig tilstand mange forbindelser?
1. Endotermisk natur:
* Vand: Konvertering af flydende vand til vanddamp kræver energiindgang, hvilket gør det til en endotermisk proces . Denne energi bruges til at bryde brintbindingerne mellem vandmolekyler, hvilket giver dem mulighed for at flygte ind i den gasformige fase.
* Mange forbindelser: Mange forbindelser kan gennemgå sublimering, hvor et fast stof direkte konverteres til en gas. Denne proces kan være enten endotermisk eller eksoterm afhængigt af den specifikke forbindelse. For eksempel sublimeres tøris (fast kuldioxid) i gasformigt kuldioxid, hvilket frigiver energi (eksoterm).
2. Faseændringstemperatur:
* Vand: Kogepunktet for vand er 100 ° C (212 ° F) ved standardtrykket. Dette betyder, at vand overgår fra en væske til en gas ved denne specifikke temperatur.
* Mange forbindelser: Andre forbindelser har meget forskellige kogepunkter. Nogle forbindelser koger ved meget lavere temperaturer (som propan, -42 ° C), mens andre har meget højere kogepunkter (som jern, 2862 ° C).
3. Hydrogenbinding:
* Vand: Vandmolekyler har stærke brintbindinger på grund af molekylets stærkt polære karakter. Disse bindinger skal brydes for at vand for at fordampe, hvilket kræver en betydelig mængde energi.
* Mange forbindelser: Andre forbindelser kan have svagere intermolekylære kræfter som dipol-dipol-interaktioner, London-spredningskræfter eller endda ingen intermolekylære kræfter overhovedet (som ædle gasser). Disse svagere kræfter kræver mindre energi for at bryde, hvilket fører til lavere kogepunkter.
4. Tilstedeværelse af vand i atmosfæren:
* Vand: Vanddamp er en betydelig komponent i jordens atmosfære. Dets tilstedeværelse påvirker vejrmønstre, klima og planetens samlede energibalance.
* Mange forbindelser: Mens andre forbindelser kan eksistere i atmosfæren, er de generelt til stede i meget mindre mængder og har ikke den samme udbredte påvirkning som vanddamp.
5. Betydning for livet:
* Vand: Vand er vigtigt for livet og spiller en vigtig rolle i biologiske processer. Dens evne til at fordampe og kondensere driver vandcyklussen og understøtter væksten af økosystemer.
* Mange forbindelser: Mens andre forbindelser kan have vigtige anvendelser, er de ikke så grundlæggende for livet som vand.
I sammendraget, mens vand deler nogle generelle egenskaber med andre forbindelser, får dens unikke egenskaber relateret til hydrogenbinding, faseændringstemperatur og atmosfærisk tilstedeværelse det til at skille sig ud som en afgørende komponent for Jordens klima og liv.
Sidste artikelHvordan ser partikler i faste og gasjod ud?
Næste artikelHvilke gasser udgør sur regn?
 Varme artikler
Varme artikler
-
 Et molekylært kig på begyndende HDL-dannelseForskere ved Boston University brugte en trunkeret version af Apolipoprotein A-I, vist her, at fastslå endegyldigt, at proteinet skal bindes til lipidtransportøren ABCA1 for at begynde at danne high-d
Et molekylært kig på begyndende HDL-dannelseForskere ved Boston University brugte en trunkeret version af Apolipoprotein A-I, vist her, at fastslå endegyldigt, at proteinet skal bindes til lipidtransportøren ABCA1 for at begynde at danne high-d -
 Ny makrolakton -database kan hjælpe med at opdage lægemidler, forskningKredit:North Carolina State University Forskere fra North Carolina State University og Collaborations Pharmaceuticals har oprettet en gratis database med 14, 000 kendte makrolaktoner - store molek
Ny makrolakton -database kan hjælpe med at opdage lægemidler, forskningKredit:North Carolina State University Forskere fra North Carolina State University og Collaborations Pharmaceuticals har oprettet en gratis database med 14, 000 kendte makrolaktoner - store molek -
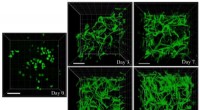 Biopolymerer til sårbehandling leverer stamceller for at forbedre helingenFigur viser det celleledende miljø af gellangummi-kollagen IPN-hydrogeler. De indkapslede fedtafledte mesenkymale stamceller (ADSCer) udviser gradvis tilbagevenden af morfologi til deres sædvanlige
Biopolymerer til sårbehandling leverer stamceller for at forbedre helingenFigur viser det celleledende miljø af gellangummi-kollagen IPN-hydrogeler. De indkapslede fedtafledte mesenkymale stamceller (ADSCer) udviser gradvis tilbagevenden af morfologi til deres sædvanlige -
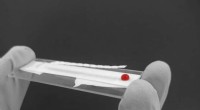 Radikal diagnostik kan redde millioner af mennesker, der risikerer at dø af blodtabFibrinogendiagnostik udviklet af forskere ved Monash University. Kredit:Monash University / BioPRIA Ingeniører ved Monash University i Australien har udviklet en hurtig, bærbar og billig diagnosti
Radikal diagnostik kan redde millioner af mennesker, der risikerer at dø af blodtabFibrinogendiagnostik udviklet af forskere ved Monash University. Kredit:Monash University / BioPRIA Ingeniører ved Monash University i Australien har udviklet en hurtig, bærbar og billig diagnosti
- En cirkulær økonomi af plast vil reducere plastforurening og bremse klimaændringer
- Holografisk histopatologi muliggør hurtig, præcis diagnostik
- Hvad er en egenskab ved arkaebakterier?
- Flying-V flykoncept markerer et spektakulært nyt look inden for flyrejser
- Ny forskning for at udforske teknologi, der er nødvendig for peer-to-peer fri handel med overskyden…
- Er kationer positive ioner, der er ikke -metaller?


