Hvilke ioner dannes af de forskellige familier?
Grupper 1 &2 (Alkali Metals &Alkaline Earth Metals)
* gruppe 1 (alkalimetaller): Disse metaller danner +1 ioner. De mister en elektron for at opnå en stabil elektronkonfiguration.
* Eksempel:natrium (NA) danner Na+
* gruppe 2 (alkaliske jordmetaller): Disse metaller danner +2 ioner. De mister to elektroner for at opnå en stabil elektronkonfiguration.
* Eksempel:Magnesium (Mg) danner mg+2
gruppe 13 (borgruppe)
* Denne gruppe danner +3 ioner generelt. De mister tre elektroner for at opnå en stabil konfiguration. Der er dog nogle undtagelser.
* Eksempel:Aluminium (AL) danner AL+3
gruppe 14 (Carbon Group)
* Elementer i denne gruppe har en tendens til at danne en række ioner, ofte med kovalent binding.
* Eksempel:Carbon (c) kan danne både +4 og -4 ioner, men disse ses sjældent som uafhængige ioner.
gruppe 15 (nitrogengruppe)
* Disse elementer har en tendens til at danne -3 ioner og få tre elektroner for at opnå en stabil konfiguration.
* Eksempel:Nitrogen (n) danner N-3
gruppe 16 (Oxygen Group)
* Disse elementer har en tendens til at danne -2 ioner og få to elektroner for at opnå en stabil konfiguration.
* Eksempel:Oxygen (O) danner O-2
gruppe 17 (halogener)
* Disse elementer har en tendens til at danne -1 ioner og få et elektron for at opnå en stabil konfiguration.
* Eksempel:Chlor (CL) danner Cl-
gruppe 18 (ædelgasser)
* Noble gasser er generelt ureaktive, fordi de har en fuld ydre skal af elektroner. De danner sjældent ioner.
Overgangsmetaller
* Overgangsmetaller kan danne flere ioner på grund af involvering af D-orbitaler. De kan miste elektroner fra både S- og D -orbitaler.
* Eksempel:Jern (Fe) kan danne Fe+2 og Fe+3 -ioner.
Vigtige noter:
* Undtagelser: Der er altid undtagelser fra disse generelle tendenser. Nogle elementer danner ioner med forskellige ladninger, og nogle former ioner, der ikke er typiske for deres gruppe.
* opladning: Anklagen for en ion bestemmes af antallet af opnåede elektroner eller mistet. En positiv ladning indikerer en ion, der har mistet elektroner, og en negativ ladning indikerer en ion, der har vundet elektroner.
* ioniske forbindelser: Når metaller og ikke -metaller reagerer, danner de ioniske forbindelser. Disse forbindelser holdes sammen af elektrostatiske kræfter mellem positivt ladede kationer og negativt ladede anioner.
Jeg håber, at denne forklaring hjælper!
Sidste artikelHvad er et ikke -eksempel på kemisk ligning?
Næste artikelHvilken slags gas indeholder heilium?
 Varme artikler
Varme artikler
-
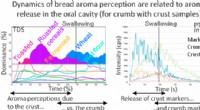 Hvorfor en sprækkelig skorpe er afgørende for en baguettes aroma og smagKredit:American Chemical Society En autentisk fransk baguette er en af de vigtigste råvarer, som foodies jagter efter. Nu har forskere fået ny indsigt i, hvorfor en sprød skorpe er et must til d
Hvorfor en sprækkelig skorpe er afgørende for en baguettes aroma og smagKredit:American Chemical Society En autentisk fransk baguette er en af de vigtigste råvarer, som foodies jagter efter. Nu har forskere fået ny indsigt i, hvorfor en sprød skorpe er et must til d -
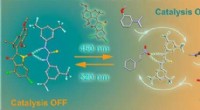 Lysstyret nanomaskine styrer katalyseSupramolekylær relæ-kontrol af organokatalyse med en hemithioindigo-baseret molekylær motor, Grafisk abstrakt. Visionen om fremtiden for miniaturisering har produceret en række syntetiske molekylæ
Lysstyret nanomaskine styrer katalyseSupramolekylær relæ-kontrol af organokatalyse med en hemithioindigo-baseret molekylær motor, Grafisk abstrakt. Visionen om fremtiden for miniaturisering har produceret en række syntetiske molekylæ -
 Strukturelle udsvingsvurderinger i stoffer ud fra måledataBlå linjer i figur (b) beskriver den korrekte radiale strukturfunktion, N(R), som bestemt af materialets struktur. N(R) har radiale komponenter (antallet af koordinerende atomer) ved sparsom interatom
Strukturelle udsvingsvurderinger i stoffer ud fra måledataBlå linjer i figur (b) beskriver den korrekte radiale strukturfunktion, N(R), som bestemt af materialets struktur. N(R) har radiale komponenter (antallet af koordinerende atomer) ved sparsom interatom -
 Dyrkning af HCA -krystallerKredit:ESS/Fisher Zoë Fisher og Katarina Koruza fra ESS Deuteration and Macromolecular Crystallization (DEMAX) Support lab og Lunds Universitet har brugt dampdiffusionsmetoder til at dyrke store p
Dyrkning af HCA -krystallerKredit:ESS/Fisher Zoë Fisher og Katarina Koruza fra ESS Deuteration and Macromolecular Crystallization (DEMAX) Support lab og Lunds Universitet har brugt dampdiffusionsmetoder til at dyrke store p
- Stigende trædødelighed i en opvarmende verden
- Hvad er et eksempel på, hvordan tekstur kan give ledetråde til, og hvor dannet en klippe?
- Sådan fungerer olieraffinering
- Hvilket svar beskriver Hvordan en ionbinding dannes?
- Når varme ophører med at være et mysterium, spintronics bliver mere ægte
- Kalksten er den overordnede klippe af ikke -folierede metamorfe kaldet?


