Hvorfor har ioniske forbindelser en tendens til at have højere kogepunkter end molekylær?
ioniske forbindelser:
* Stærke elektrostatiske attraktioner: Ioniske forbindelser består af positivt ladede kationer og negativt ladede anioner holdt sammen af stærke elektrostatiske kræfter. Disse kræfter er meget stærkere end kræfterne mellem molekyler i molekylære forbindelser.
* gitterstruktur: Ioner i ioniske forbindelser danner en stiv, tredimensionel gitterstruktur. Denne struktur kræver en betydelig mængde energi for at bryde fra hinanden, hvilket fører til høje smelte- og kogepunkter.
molekylære forbindelser:
* svagere intermolekylære kræfter: Molekylære forbindelser holdes sammen af svagere intermolekylære kræfter, såsom van der Waals-kræfter, hydrogenbinding og dipol-dipol-interaktioner. Disse kræfter er meget svagere end de elektrostatiske kræfter i ioniske forbindelser.
* Mindre energi, der kræves for at bryde obligationer: De svagere intermolekylære kræfter i molekylære forbindelser kræver mindre energi til at overvinde, hvilket resulterer i lavere smelte- og kogepunkter.
Kortfattet:
De stærkere elektrostatiske attraktioner og stive gitterstruktur i ioniske forbindelser kræver en meget højere mængde energi at overvinde sammenlignet med de svagere intermolekylære kræfter i molekylære forbindelser. Dette resulterer i, at ioniske forbindelser har signifikant højere smeltnings- og kogepunkter end molekylære forbindelser.
 Varme artikler
Varme artikler
-
 Mikrofluidiske enheder afklarer, hvordan dispergeringsmidler modificerer asfalten for at holde rør …Ris postdoc-forsker Peng He, venstre, og kandidatstuderende Yu-Jiun Lin kører en prøve af råolie gennem en mikrofluidisk enhed, der giver dem mulighed for at se opbygningen af asfaltener i realtid.
Mikrofluidiske enheder afklarer, hvordan dispergeringsmidler modificerer asfalten for at holde rør …Ris postdoc-forsker Peng He, venstre, og kandidatstuderende Yu-Jiun Lin kører en prøve af råolie gennem en mikrofluidisk enhed, der giver dem mulighed for at se opbygningen af asfaltener i realtid. -
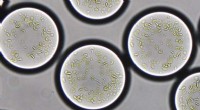 Forskere udvikler en kunstig kloroplastPlantethylacoider er indkapslet i mikrodråber på cirka 90 mikrometer i diameter. Udstyret med et sæt enzymer, de semisyntetiske kloroplaster fikserer kuldioxid ved hjælp af solenergi, efter naturens e
Forskere udvikler en kunstig kloroplastPlantethylacoider er indkapslet i mikrodråber på cirka 90 mikrometer i diameter. Udstyret med et sæt enzymer, de semisyntetiske kloroplaster fikserer kuldioxid ved hjælp af solenergi, efter naturens e -
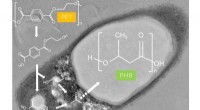 Hvordan en bakterie kan hjælpe med at løse plastikforureningskrisenI. sakaiensis dyrket på poly (ethylenterephthalat) (PET) akkumulerer poly (3-hydroxybutyrat) (PHB). Kredit:Shosuke Yoshida Plastforurening er et af de mest presserende miljøspørgsmål i vores tid.
Hvordan en bakterie kan hjælpe med at løse plastikforureningskrisenI. sakaiensis dyrket på poly (ethylenterephthalat) (PET) akkumulerer poly (3-hydroxybutyrat) (PHB). Kredit:Shosuke Yoshida Plastforurening er et af de mest presserende miljøspørgsmål i vores tid. -
 Kemikere, der overraskende opdagede nanokonfinerede reaktioner, kunne hjælpe med katalytisk designKredit:Georgia State University Georgia State University kemiforskere har afsløret et af mysterierne bag katalytiske reaktioner i mikroskopisk skala, giver mulighed for design af mere effektive in
Kemikere, der overraskende opdagede nanokonfinerede reaktioner, kunne hjælpe med katalytisk designKredit:Georgia State University Georgia State University kemiforskere har afsløret et af mysterierne bag katalytiske reaktioner i mikroskopisk skala, giver mulighed for design af mere effektive in
- Hvad er cusoh2o?
- En hvis ved at redigere, to ved vejspærring:Humant protein bekæmper HIV som monomer og dimer
- Hvilke stoffer tager eleverne, og hvorfor tager de dem?
- Hvad bestemmer et atoms kemiske opførsel?
- Paris vil sagsøge Airbnb for uanmeldte annoncer
- Fighting askeborer:At sprøjte eller ikke at sprøjte?


