Hvorfor udvides materialer og kontraherer, når temperaturen ændres?
1. Varme og molekylær bevægelse:
* Når du opvarmer et materiale, øger du i det væsentlige den kinetiske energi fra dets atomer og molekyler. Dette får dem til at vibrere hurtigere og bevæge sig mere kraftigt.
* Når molekylerne bevæger sig mere, har de en tendens til at besætte et større volumen, hvilket fører til ekspansion.
2. Termisk ekspansion:
* lineær ekspansion: Faststoffer ekspanderer i alle tre dimensioner (længde, bredde og højde). Dette kaldes lineær ekspansion. Ændringen i længde (ΔL) er proportional med den oprindelige længde (L), ændringen i temperatur (ΔT) og koefficienten for lineær ekspansion (α) for materialet:ΔL =αLΔT.
* Volumenudvidelse: Væsker og gasser udvides i alle tre dimensioner, hvilket resulterer i volumenudvidelse. Ændringen i volumen (ΔV) er proportional med det originale volumen (V), ændringen i temperatur (ΔT) og koefficienten for volumenudvidelse (β) for materialet:ΔV =βVΔT.
3. Intermolekylære kræfter:
* Styrken af de intermolekylære kræfter mellem molekyler spiller også en rolle.
* stærkere kræfter (som i faste stoffer) resulterer i mindre ekspansion for en given temperaturændring.
* svagere kræfter (som i gasser) resulterer i mere betydelig ekspansion.
4. Undtagelser og overvejelser:
* vand er en bemærkelsesværdig undtagelse: Vand udvides, når det fryser, hvorfor is flyder. Dette skyldes hydrogenbindingerne, der danner en krystallinsk struktur, der tager mere plads end flydende vand.
* Faseændringer: Materialer kan også ændre faser (fast, flydende, gas) på grund af temperaturændringer. Disse faseændringer involverer betydelige volumenændringer.
Sammenfattende er udvidelsen og sammentrækningen af materialer med temperaturændringer en direkte konsekvens af den øgede eller nedsatte kinetiske energi fra atomer og molekyler inden for materialet, hvilket fører til ændringer i den gennemsnitlige afstand mellem dem.
Sidste artikelHvad er negativt poretryk?
Næste artikelHvorfor bruges wolfram til LiHJT -pærefilamenter?
 Varme artikler
Varme artikler
-
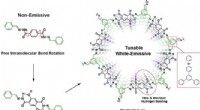 Justerbar emissiv organisk platformFigur viser designprincipperne for udvikling af en justerbar 2D COF, der er i stand til at udsende hvidt lys. Den frie intramolekylære bindingsrotation gør den grundlæggende molekylære enhed ikke-emit
Justerbar emissiv organisk platformFigur viser designprincipperne for udvikling af en justerbar 2D COF, der er i stand til at udsende hvidt lys. Den frie intramolekylære bindingsrotation gør den grundlæggende molekylære enhed ikke-emit -
 Forskere skabte spiselige film til fødevareemballageRammohan Aluru (til venstre) og Grigory Zyryanov (til højre) i forskningsgruppen skabte spiselige madfilm på tangen. Kredit:UrFU / Andrei Fomin En international gruppe af forskere fra Indien og Ru
Forskere skabte spiselige film til fødevareemballageRammohan Aluru (til venstre) og Grigory Zyryanov (til højre) i forskningsgruppen skabte spiselige madfilm på tangen. Kredit:UrFU / Andrei Fomin En international gruppe af forskere fra Indien og Ru -
 Adskillelse af ølaffald til proteiner til fødevarer, og fiber til biobrændstofferKredit:Pixabay/CC0 Public Domain Både hjemmebryggere og større producenter oplever det samme resultat af ølfremstillingsprocessen:høje rester af korn. Når al smagen er ekstraheret fra byg og andre
Adskillelse af ølaffald til proteiner til fødevarer, og fiber til biobrændstofferKredit:Pixabay/CC0 Public Domain Både hjemmebryggere og større producenter oplever det samme resultat af ølfremstillingsprocessen:høje rester af korn. Når al smagen er ekstraheret fra byg og andre -
 Studer polyfarmakologi tidligere i lægemiddelopdagelsen, siger forskereKredit:CC0 Public Domain Polyfarmakologi - et lægemiddels evne til at påvirke mere end ét protein - bør studeres tidligt i lægemiddelopdagelsesforløbet, og konstant overvåget, da den kemiske struk
Studer polyfarmakologi tidligere i lægemiddelopdagelsen, siger forskereKredit:CC0 Public Domain Polyfarmakologi - et lægemiddels evne til at påvirke mere end ét protein - bør studeres tidligt i lægemiddelopdagelsesforløbet, og konstant overvåget, da den kemiske struk
- Hvordan klimaændringer formede Amazonas land og liv
- Healer en akilleshæl af kvanteforviklinger
- Periodisk gennemgang af kunstig intelligens-industrien afslører udfordringer
- Hvad er mængden af energi i en mad målt i?
- EP-WXT pathfinder fanger de første wide-field snapshots af røntgenuniverset
- Sådan laver du en kolibriestet


