Hvilket af oxidet reagerer med både saltsyre og natriumhydroxid?
Her er hvorfor:
* amfoteriske oxider kan fungere som både syrer og baser.
* med syrer , de fungerer som baser og accepterer protoner (H+) til dannelse af salte og vand.
* med baser , de fungerer som syrer, donerer protoner (H+) til dannelse af salte og vand.
Eksempler på amfoteriske oxider:
* aluminiumoxid (al₂o₃)
* zinkoxid (ZnO)
* bly (ii) oxid (PBO)
* tin (II) oxid (SNO)
reaktioner:
med saltsyre:
* Al₂o₃ + 6HCl → 2Alcl₃ + 3H₂O
* ZnO + 2HCl → Zncl₂ + H₂O
med natriumhydroxid:
* Al₂o₃ + 2naOH + 3H₂O → 2NA [AL (OH) ₄]
* Zno + 2naOH + H₂O → Na₂ [Zn (OH) ₄]
Vigtig note: Nogle oxider, som overgangsmetaller, kan udvise amfoterisk opførsel afhængigt af deres oxidationstilstand og reaktionsbetingelser.
 Varme artikler
Varme artikler
-
 Opdagelse af en ny kilde til verdens dødeligste toksinForudsagt proteinstruktur af nyt botulinumneurotoksin eBonT/J. Billede:Quadram Institute Forskere fra Quadram Institute har identificeret gener, der koder for en tidligere uopdaget version af botu
Opdagelse af en ny kilde til verdens dødeligste toksinForudsagt proteinstruktur af nyt botulinumneurotoksin eBonT/J. Billede:Quadram Institute Forskere fra Quadram Institute har identificeret gener, der koder for en tidligere uopdaget version af botu -
 Fremstilling af åbne mesoporøse carbon nanofibre til fleksible og bærbare strømkilderKredit:CC0 Public Domain Med den nyligt stigende udvikling af letvægts, transportabel, fleksibel og bærbar elektronik til sundheds- og biomedicinsk udstyr, der er et presserende behov for at udfor
Fremstilling af åbne mesoporøse carbon nanofibre til fleksible og bærbare strømkilderKredit:CC0 Public Domain Med den nyligt stigende udvikling af letvægts, transportabel, fleksibel og bærbar elektronik til sundheds- og biomedicinsk udstyr, der er et presserende behov for at udfor -
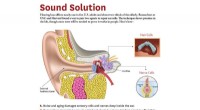 Tilslutning af hørehjælpemolekyler til øreknoglenKredit:USC Forskere ved USC og Harvard har udviklet en ny tilgang til at reparere celler dybt inde i øret - et potentielt middel, der kan genoprette hørelsen for millioner af ældre mennesker og an
Tilslutning af hørehjælpemolekyler til øreknoglenKredit:USC Forskere ved USC og Harvard har udviklet en ny tilgang til at reparere celler dybt inde i øret - et potentielt middel, der kan genoprette hørelsen for millioner af ældre mennesker og an -
 Integreret lab-on-a-chip bruger smartphone til hurtigt at opdage flere patogenerSystemet bruger en kommerciel smartphone til at erhverve og fortolke realtidsbilleder af en enzymatisk amplifikationsreaktion, der finder sted i en siliciummikrofluidisk chip, der genererer grøn fluor
Integreret lab-on-a-chip bruger smartphone til hurtigt at opdage flere patogenerSystemet bruger en kommerciel smartphone til at erhverve og fortolke realtidsbilleder af en enzymatisk amplifikationsreaktion, der finder sted i en siliciummikrofluidisk chip, der genererer grøn fluor
- Forskning identificerer klimaforandringers fingeraftryk og udsenderansvar
- Hvad hedder det, når vand bevæger sig rundt om jorden?
- Hubble opdager mystisk sort hul-skive
- Øvre kridtgravaflejringer i Neo-Tethyan subduktionszonen
- Hvordan satellitsporing afslørede vandrende mysterier for truede atlantiske skildpadder
- Fem eksempler på salte til Science Class


