Hvordan finder du koncentration af en syre fra en titrering?
Forståelse af titrering
Titrering er en teknik, der bruges til at bestemme den ukendte koncentration af en opløsning (analyt) ved at reagere den med en opløsning af kendt koncentration (titrant).
* syre-base titrering: I syre-base-titrationer bruger vi en kendt koncentration af en base til at neutralisere et kendt volumen af en sur opløsning. Slutpunktet nås, når syren og basen har reageret fuldstændigt.
trin for at bestemme syrekoncentration
1. Materialer:
* burette: Et gradueret rør, der blev brugt til at levere Titrant (base) nøjagtigt.
* pipette: En enhed til nøjagtigt at måle volumen af syren (analyt).
* bægerglas: Beholder til at holde syreopløsningen.
* Erlenmeyer kolbe: Container til titreringsreaktionen.
* indikator: Et stof, der ændrer farve ved slutpunktet for titreringen (f.eks. Phenolphthalein).
2. Procedure:
* Forberedelse:
* Mål nøjagtigt et kendt volumen af syreopløsningen ved hjælp af en pipette og overfør den til Erlenmeyer -kolben.
* Tilføj et par dråber af en passende indikator til kolben.
* Fyld buretten med standardbaseløsningen.
* titrering:
* Tilsæt langsomt basisopløsningen fra buretten til syreopløsningen i kolben, mens den hvirvler kontinuerligt.
* Overhold farveændringen af indikatoren. Farveændringen indikerer slutpunktet for titreringen.
* Registrer de indledende og endelige buretteaflæsninger for at bestemme den anvendte baseopløsning.
3. Beregninger:
* mol basis:
* Multiplicer mængden af anvendt base (i liter) med den kendte koncentration af basen (i mol pr. Liter).
* `Mol basis =volumen af base (l) * Koncentration af base (mol/l)`
* mol syre:
* Syren og basen reagerer i et støkiometrisk forhold. Dette forhold bestemmes af den afbalancerede kemiske ligning for reaktionen. I reaktionen af HCI (syre) med NaOH (base) er forholdet for eksempel 1:1.
* `Mol syre =mol base * (støkiometrisk forhold)`
* Koncentration af syre:
* Opdel molen af syre med mængden af syreopløsning (i liter).
* `Koncentration af syre (mol / l) =mol syre / volumen syre (l)`
Eksempel:
Antag, at du titrerer 25,0 ml af en ukendt saltsyre (HCI) opløsning med 0,100 M natriumhydroxid (NaOH) opløsning. Slutpunktet for titreringen nås, når 18,5 ml NaOH tilsættes.
1. 18,5 ml =0,0185 L
2. mol basis: 0,0185 L * 0,100 mol/l =0,00185 mol
3. mol syre: Da reaktionen er HCl + NaOH → NaCl + H2O, er forholdet 1:1. Så 0,00185 mol HCl reagerede.
4. koncentration af syre: 0,00185 mol / 0,0250 L =0,0740 mol / l
Derfor er koncentrationen af saltsyreopløsningen 0,0740 m.
Vigtige noter:
* Nøjagtighed: Præcise målinger af volumener og koncentrationer er afgørende for nøjagtige resultater.
* Endpoint vs. ækvivalenspunkt: Slutpunktet er det punkt, hvor indikatoren ændrer farve, mens ækvivalenspunktet er det punkt, hvor syren og basen helt har reageret. Disse to punkter er ikke altid nøjagtigt de samme, men de er normalt tæt nok til nøjagtige resultater.
* Valg af den rigtige indikator: Indikatoren skal vælges, så dens farveændring forekommer tæt på ækvivalenspunktet.
Fortæl mig, hvis du har flere spørgsmål!
Sidste artikelEr kaboran super syre den stærkeste syre?
Næste artikelKan du erstatte muratisk syre med batterisyre?
 Varme artikler
Varme artikler
-
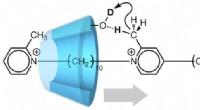 Molekylær maskine udnytter bevægelse i en enkelt retningFig.1. En pseudo-rotaxan (kunstig molekylær maskine), hvor translationel bevægelse af α-cyclodextrin (α-CD) falder sammen med deuteration. Når α-CD bevæger sig langs to-stationsaksemolekylet som vist
Molekylær maskine udnytter bevægelse i en enkelt retningFig.1. En pseudo-rotaxan (kunstig molekylær maskine), hvor translationel bevægelse af α-cyclodextrin (α-CD) falder sammen med deuteration. Når α-CD bevæger sig langs to-stationsaksemolekylet som vist -
 Gennemsigtig keramisk rustning giver overlegen ballistisk beskyttelse over traditionelle glaslaminat…Army UH-60M helikopterplatforme bruger gennemsigtige rustningssystemer monteret bag piloterne. Kredit:Air Force Office of Scientific Research Gennemsigtig aluminium, en teknologi, der først blev f
Gennemsigtig keramisk rustning giver overlegen ballistisk beskyttelse over traditionelle glaslaminat…Army UH-60M helikopterplatforme bruger gennemsigtige rustningssystemer monteret bag piloterne. Kredit:Air Force Office of Scientific Research Gennemsigtig aluminium, en teknologi, der først blev f -
 Neutroner undersøger molekylær adfærd hos foreslåede COVID-19 lægemiddelkandidaterBrug af neutroner, ORNL-forskere analyserede den molekylære dynamik i tidligere foreslåede COVID-19 lægemiddelkandidater remdesivir (til venstre), hydroxychlorokin (i midten), og dexamethason (til høj
Neutroner undersøger molekylær adfærd hos foreslåede COVID-19 lægemiddelkandidaterBrug af neutroner, ORNL-forskere analyserede den molekylære dynamik i tidligere foreslåede COVID-19 lægemiddelkandidater remdesivir (til venstre), hydroxychlorokin (i midten), og dexamethason (til høj -
 Undersøgelse opdager nyt leveringssystem, der kan hjælpe med at forhindre bakterielle infektionerKredit:CC0 Public Domain I en nylig undersøgelse i Journal of The American Chemical Society , Professor Tewodros Asefa og lektor Jeffrey Boyd syntetiserede nanostrukturerede silicapartikler, ans
Undersøgelse opdager nyt leveringssystem, der kan hjælpe med at forhindre bakterielle infektionerKredit:CC0 Public Domain I en nylig undersøgelse i Journal of The American Chemical Society , Professor Tewodros Asefa og lektor Jeffrey Boyd syntetiserede nanostrukturerede silicapartikler, ans
- Hvad er en centrifugalblæser?
- Hvor meget af Nordpolen er jord?
- Metan har fire kovalente bindinger, og hvor mange ensomme par?
- Forskning tyder på, at større banker er værre for kunderne
- Flere mennesker dør om vinteren end om sommeren, men klimaændringer kan se dette omvendt
- Spørgsmål og svar:Fik du dig ned i valgsæsonen? Tips til at styre din mentale sundhed


