Foretrækker metaller at blive oxideret eller reduceret?
Her er hvorfor:
* Oxidation er processen med at miste elektroner. Metaller har en tendens til at miste elektroner og danne positive ioner. Dette skyldes, at de har relativt få elektroner i deres ydre skaller, hvilket gør det lettere for dem at miste disse elektroner og opnå en mere stabil konfiguration.
* reduktion er processen med at vinde elektroner. Mens metaller * kan * reduceres under specifikke forhold, er det mindre almindeligt i deres naturlige tilstand.
Eksempler:
* Jernrustning:Jern (Fe) oxideres til jernoxid (fe₂o₃) i nærvær af ilt og vand.
* ALUMINIUM REACTING MED ACID:Aluminium (AL) oxideres til aluminiumioner (al³⁺), når man reagerer med syrer.
Nøglepunkt: Metallers tendens til at blive oxideret er det, der gør dem nyttige i mange anvendelser, såsom i batterier og korrosionsbestandige belægninger.
Sidste artikelHvordan kan den store mængde vandopløselige faste stoffer bortskaffes?
Næste artikelHvad er den konjugerede base af Cho3?
 Varme artikler
Varme artikler
-
 Hyperpolariseret proton -MR bruges til at observere metaboliske processer i realtidFantomet brugt til hyperpolariseret billeddannelse, med en illustration af billedskiver erhvervet ved hjælp af den nye teknik. Kredit:©:Laurynas Dagys, University of Southampton Magnetic resonance
Hyperpolariseret proton -MR bruges til at observere metaboliske processer i realtidFantomet brugt til hyperpolariseret billeddannelse, med en illustration af billedskiver erhvervet ved hjælp af den nye teknik. Kredit:©:Laurynas Dagys, University of Southampton Magnetic resonance -
 Opfinder verdens stærkeste sølvInde i et sølvkorn, kobberatomurenheder (i grønt) er blevet selektivt adskilt til en korngrænse (til venstre) og til indre defekter (lange strenge, streamer nedad.) Dette øjebliksbillede, fra en atomi
Opfinder verdens stærkeste sølvInde i et sølvkorn, kobberatomurenheder (i grønt) er blevet selektivt adskilt til en korngrænse (til venstre) og til indre defekter (lange strenge, streamer nedad.) Dette øjebliksbillede, fra en atomi -
 En ny enkeltatomskatalysator kan producere hydrogen fra urinstof i en usædvanlig hastighedDet skematiske diagram for UOR-processen ved hjælp af højtbelastet RhSA stabiliseret på anstrengt oxidoverflade (til venstre). Fuld urinstof elektrolysesystem til grøn hydrogenudvikling (midten). Ener
En ny enkeltatomskatalysator kan producere hydrogen fra urinstof i en usædvanlig hastighedDet skematiske diagram for UOR-processen ved hjælp af højtbelastet RhSA stabiliseret på anstrengt oxidoverflade (til venstre). Fuld urinstof elektrolysesystem til grøn hydrogenudvikling (midten). Ener -
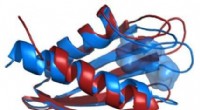 Røntgenøjne kigger dybere ind i dødbringende patogenSammenligning af strukturerne af Flpp3-proteinrygraden som afledt af en røntgenfri elektronlaser (rød) og fra NMR (blå) afslører et indre hulrum, der er unikt for NMR-strukturen og antyder derfor eksi
Røntgenøjne kigger dybere ind i dødbringende patogenSammenligning af strukturerne af Flpp3-proteinrygraden som afledt af en røntgenfri elektronlaser (rød) og fra NMR (blå) afslører et indre hulrum, der er unikt for NMR-strukturen og antyder derfor eksi
- Hvilke gasser produceres, når brændstof brændes i biler?
- Vælgers adfærd påvirket af varmt vejr
- Jagten på (potentielt) livgivende vand under Mars
- Hvad er højden af Mount Chimborazo?
- Videospil kan forbedre din mentale matematik
- Storbritanniens foreslåede forbud kan gå glip af vigtige produkter, der indeholder mikroplast


