Liste over følgende bindinger til brint i rækkefølge af stigende polaritet C-H O-H al-H N-H?
Forståelse af polaritet
Polaritet i en binding opstår fra forskellen i elektronegativitet mellem de to involverede atomer. Elektronegativitet er et atoms evne til at tiltrække elektroner i en binding. Jo større forskellen i elektronegativitet er, jo mere polær er bindingen.
Elektronegativitetstendenser
* øges over en periode (venstre til højre): Atomer på højre side af den periodiske tabel er mere elektronegative.
* falder ned i en gruppe (top til bund): Atomer højere op i en gruppe er mere elektronegative.
analyse af obligationerne
1. c-h: Carbon og brint har relativt ens elektronegativiteter, hvilket resulterer i en meget ikke -polær bånd.
2. al-h: Aluminium er et metal og har signifikant lavere elektronegativitet end brint. Dette gør obligationen meget polar , hvor brint er det mere elektronegative atom.
3. n-h: Nitrogen er mere elektronegativ end brint, hvilket skaber en polær bånd.
4. o-h: Oxygen er det mest elektronegative atom ud af de fire, hvilket gør O-H-bindingen mest polære af gruppen.
bestiller obligationerne
Fra mindst til de fleste polære:
1. c-h (mindst polær)
2. n-h
3. al-h
4. o-h (de fleste polære)
Sidste artikelHvad har funktionen til at transportere ilt og kuldioxid?
Næste artikelHvordan laver man kul i lidt alkymi?
 Varme artikler
Varme artikler
-
 Byggesæt til specialdesignede produkterFra venstre mod højre:Dr. Yan-Ni Shi, Prof. Helge Bode, Janik Kranz, Peter Grün og Andreas Tietze. Kredit:Jürgen Lecher, Goethe Universitet Mikroorganismer samler ofte naturlige produkter svarende
Byggesæt til specialdesignede produkterFra venstre mod højre:Dr. Yan-Ni Shi, Prof. Helge Bode, Janik Kranz, Peter Grün og Andreas Tietze. Kredit:Jürgen Lecher, Goethe Universitet Mikroorganismer samler ofte naturlige produkter svarende -
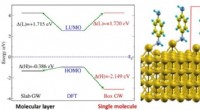 Energiniveaujustering for molekylær elektronik(Venstre) Figur viser elektronenerginiveaujusteringen af benzen-diaminmolekyler på guldoverfladesystemet (vist til højre). Energiniveauerne er vist for et molekylært lag (sort) og for et enkelt mole
Energiniveaujustering for molekylær elektronik(Venstre) Figur viser elektronenerginiveaujusteringen af benzen-diaminmolekyler på guldoverfladesystemet (vist til højre). Energiniveauerne er vist for et molekylært lag (sort) og for et enkelt mole -
 Nyt solcellemateriale kunne rense drikkevandetMed hærens finansiering har forskere ved University of Rochester udviklet et aluminiumspanel, der vinkles mod solen, renser vand. Kredit:Udlånt af University of Rochester At skaffe rent vand til s
Nyt solcellemateriale kunne rense drikkevandetMed hærens finansiering har forskere ved University of Rochester udviklet et aluminiumspanel, der vinkles mod solen, renser vand. Kredit:Udlånt af University of Rochester At skaffe rent vand til s -
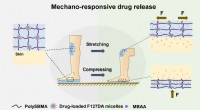 Mechano-responsiv hydrogel udviklet til sårhelingSkematisk illustration af mechano-responsiv hydrogel til sårheling. Kredit:NIMTE Dr. Wang Rongs team fra Cixi Institute of Biomedical Engineering, Ningbo Institute of Materials Technology and Engi
Mechano-responsiv hydrogel udviklet til sårhelingSkematisk illustration af mechano-responsiv hydrogel til sårheling. Kredit:NIMTE Dr. Wang Rongs team fra Cixi Institute of Biomedical Engineering, Ningbo Institute of Materials Technology and Engi
- Hvorfor understøtter kropsstrukturer af nogle arter S -teorier?
- Forskning viser en ny mekanisme for ordensdannelse i kvantesystemer
- Symmetri er afgørende for synkronisering af strømnetværk
- Hvordan gær formår at kompensere for den genetiske ubalance af ekstra kromosomer
- Kulaflejringer dannes af hvad?
- Hvilken proces ændrer brint til helium i en stjerne?


