Hvad er kravet om, at et molekyle skal være UV -aktivt?
1. Tilstedeværelse af kromoforer:
* kromoforer er funktionelle grupper inden for et molekyle, der har et system med konjugerede dobbelt- eller tredobbeltbindinger. Disse konjugerede systemer muliggør delokalisering af elektroner, hvilket skaber molekylære orbitaler med energiniveauet tæt nok til at blive begejstret ved UV -stråling.
* Eksempler: Carbonyl (C =O), alken (C =C), aromatiske ringe (benzen) og nitrogrupper (-no2).
2. Passende elektroniske overgange:
* UV -absorption opstår, når en elektron overgår fra et lavere energiniveau (jordtilstand) til et højere energiniveau (ophidset tilstand).
* Energiforskellen mellem disse niveauer skal svare til energien fra UV -fotoner.
* De mest almindelige UV -overgange er:
* σ → σ*: Elektroner i en Sigma -binding (enkeltbinding) er glade for en antibonding Sigma Orbital. Denne overgang kræver høj energi og forekommer i den fjerne UV -region.
* n → σ*: Elektroner i en ikke-bonding orbital (f.eks. Enlige par) er glade for en antibonding Sigma Orbital. Denne overgang forekommer også i den fjerne UV.
* π → π*: Elektroner i en PI -binding (dobbelt- eller tredobbelt binding) er glade for en antibonding Pi -orbital. Denne overgang forekommer i den nærmeste UV -region og er den mest almindelige type, der er ansvarlig for UV -absorption.
3. Konjugeringsgrad:
* Forøget konjugering: Et større system med konjugerede dobbeltbindinger fører til et mindre energigap mellem de elektroniske niveauer. Dette resulterer i absorption af UV -lys med lavere energi (længere bølgelængde).
* Eksempel: Benzen (6 konjugerede PI -elektroner) absorberer ved en længere bølgelængde end ethylen (2 konjugerede PI -elektroner).
4. Molekylær struktur:
* Visse molekylære strukturer kan forbedre UV -absorptionen.
* planaritet: Plane molekyler med konjugerede systemer giver mulighed for maksimal overlapning af P -orbitaler, hvilket øger delokaliseringen af elektroner og fremmer UV -absorption.
* stivhed: Stive molekyler med faste konformationer har en tendens til at være mere UV -aktive end fleksible molekyler.
Sammenfattende er et molekyle UV -aktivt, hvis det indeholder kromoforer, kan gennemgå passende elektroniske overgange og har en struktur, der fremmer konjugering og planaritet.
Bemærk: UV -absorption er et kvantitativt fænomen. Intensiteten af UV -absorption er relateret til koncentrationen af analytten og sti -længden af UV -strålen. Dette forhold er beskrevet af Beer-Lamberts lov.
 Varme artikler
Varme artikler
-
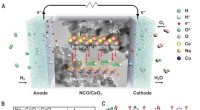 Reduktion af driftstemperaturen for keramiske brændselsceller med en elektrolyt med høj protonledn…Design af NCO/CeO2-heterostrukturfunktionerne til hurtig protonmigrering. Kredit: Videnskab (2020). DOI:10.1126/science.aaz9139 Et team af forskere tilknyttet flere institutioner i Kina har udvik
Reduktion af driftstemperaturen for keramiske brændselsceller med en elektrolyt med høj protonledn…Design af NCO/CeO2-heterostrukturfunktionerne til hurtig protonmigrering. Kredit: Videnskab (2020). DOI:10.1126/science.aaz9139 Et team af forskere tilknyttet flere institutioner i Kina har udvik -
 Skønhed i ufuldkommenhed:Hvordan krystaldefekter kan hjælpe med at omdanne spildvarme til elektric…Eksempler på anvendelser af elproduktion ved hjælp af termoelektrisk konvertering. Det involverer konvertering af udstødningsvarme fra bilmotorer til elektricitet til genbrug, eller bruge forskellen i
Skønhed i ufuldkommenhed:Hvordan krystaldefekter kan hjælpe med at omdanne spildvarme til elektric…Eksempler på anvendelser af elproduktion ved hjælp af termoelektrisk konvertering. Det involverer konvertering af udstødningsvarme fra bilmotorer til elektricitet til genbrug, eller bruge forskellen i -
 Kemisk innovation stabiliserer den bedst ydende perovskit-formuleringUdgiver i Videnskab , forskere ved EPFL har med succes overvundet et begrænsende problem med at stabilisere den bedst ydende formulering af metalhalogenid perovskitfilm, en nøglespiller i en række a
Kemisk innovation stabiliserer den bedst ydende perovskit-formuleringUdgiver i Videnskab , forskere ved EPFL har med succes overvundet et begrænsende problem med at stabilisere den bedst ydende formulering af metalhalogenid perovskitfilm, en nøglespiller i en række a -
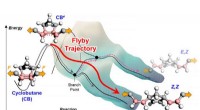 Kemiske reaktioner bryder fri fra energibarrierer ved at bruge flyby-banerEn illustration, der viser et molekyles bevægelse hen over en potentiel energioverflade på den måde, vandrere følger konturkortet over bjerge og dale langs en sti. Når der påføres en mekanisk kraft, e
Kemiske reaktioner bryder fri fra energibarrierer ved at bruge flyby-banerEn illustration, der viser et molekyles bevægelse hen over en potentiel energioverflade på den måde, vandrere følger konturkortet over bjerge og dale langs en sti. Når der påføres en mekanisk kraft, e
- En celleorganelle, der nedbryder madmolekyler og frigiver energi?
- Hvordan funktion pludselig kan opstå eller forsvinde i fysiske og biologiske systemer
- Er pH 9 mere sur end 4?
- Hvad gør varme ved sukker?
- Stoffer udvides, når de opvarmes, fordi molekylerne?
- Farveblindhed komplicerer racerelaterede samtaler mellem hvide forældre og børn


