Hvordan kan du se, hvornår du når opløseligheden af salt i vand?
1. Visuel observation:
* UNDISSOLVET SALT: Hvis du tilsætter salt til vand, og du ser faste saltkrystaller i bunden af beholderen, der ikke opløses, har du nået opløselighedsgrænsen. Løsningen er mættet.
2. Temperatur:
* opløselighed øges med temperatur: Opløseligheden af de fleste faste stoffer i væsker, inklusive salt i vand, øges, når temperaturen stiger. Hvis du opvarmer opløsningen, og mere salt opløses, ved du, at du ikke var ved opløselighedsgrænsen ved den lavere temperatur.
3. Test med mere salt:
* ikke mere opløst: Tilsæt en lille mængde salt til opløsningen. Hvis den opløses, er opløsningen stadig umættet. Hvis det ikke opløses, har du ramt opløselighedsgrænsen.
Vigtige noter:
* opløselighedsgrænse varierer: Opløseligheden af salt i vand er ca. 36 gram pr. 100 ml vand ved stuetemperatur (25 ° C). Dette kan dog variere lidt afhængigt af faktorer som temperatur og tilstedeværelsen af andre opløste stoffer.
* overmætning: Det er muligt at skabe en overmættet opløsning, hvor mere salt opløses end den normale opløselighedsgrænse tillader. Disse opløsninger er ustabile, og det overskydende salt udfælder hurtigt, hvis de forstyrres.
Fortæl mig, hvis du gerne vil udforske nogen af disse koncepter mere detaljeret!
 Varme artikler
Varme artikler
-
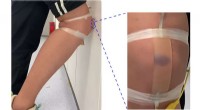 Brudbar kunstig hud kan hjælpe proteser, robotter fornemmer skaderEn kunstig hud, der er fastgjort til en persons knæ, udvikler et lilla blå mærke, når det rammer kraftigt mod et metalkabinet. Kredit:Tilpasset fra ACS Applied Materials &Interfaces Når nogen stød
Brudbar kunstig hud kan hjælpe proteser, robotter fornemmer skaderEn kunstig hud, der er fastgjort til en persons knæ, udvikler et lilla blå mærke, når det rammer kraftigt mod et metalkabinet. Kredit:Tilpasset fra ACS Applied Materials &Interfaces Når nogen stød -
 Ny forskning forklarer, hvorfor nogle molekyler har uregelmæssige formerKredit:Vanderbilt University Der er altid en grund til, hvordan molekyler dannes, og hvordan de er formet. Når først forskere forstår bindingerne i molekyler, de finder ud af måder at bruge de mat
Ny forskning forklarer, hvorfor nogle molekyler har uregelmæssige formerKredit:Vanderbilt University Der er altid en grund til, hvordan molekyler dannes, og hvordan de er formet. Når først forskere forstår bindingerne i molekyler, de finder ud af måder at bruge de mat -
 Hurtig test til diagnosticering af astmaDet holografiske mikroskop muliggør automatisk, tredimensionel sporing af immunceller i realtid. Kredit:Fraunhofer-Gesellschaft Astma er en af de mest almindelige luftvejssygdomme i verden, påvi
Hurtig test til diagnosticering af astmaDet holografiske mikroskop muliggør automatisk, tredimensionel sporing af immunceller i realtid. Kredit:Fraunhofer-Gesellschaft Astma er en af de mest almindelige luftvejssygdomme i verden, påvi -
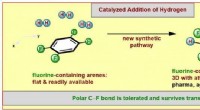 En ny metode til dannelse af fluorerede molekylære ringeillustration af den nye syntetiske metode. Kredit:WWU/Frank Glorius Farvestoffer, lægemidler, og funktionelle materialer er generelt baseret på innovative molekyler fremstillet af kemikere. Til de
En ny metode til dannelse af fluorerede molekylære ringeillustration af den nye syntetiske metode. Kredit:WWU/Frank Glorius Farvestoffer, lægemidler, og funktionelle materialer er generelt baseret på innovative molekyler fremstillet af kemikere. Til de


