Hvordan ændres opløseligheden af et stof med stigning i temperaturen?
* kinetisk energi: Når temperaturen stiger, får molekylerne af både opløsningsmiddel og opløsningsmiddel kinetisk energi. Dette betyder, at de bevæger sig hurtigere og med mere kraft. Denne øgede bevægelse hjælper de opløste molekyler med at bryde væk fra deres bindinger og spredes lettere ind i opløsningsmidlet.
* Breaking intermolekylære kræfter: Forøget kinetisk energi hjælper også med at overvinde de intermolekylære kræfter (som brintbindinger eller van der Waals -kræfter), der holder opløste molekyler sammen. Dette gør det lettere for dem at opløses i opløsningsmidlet.
Undtagelser:
* Gasser: Opløseligheden af gasser falder med en stigning i temperaturen. Dette skyldes, at gasmolekylerne har mere kinetisk energi og er mere tilbøjelige til at flygte fra væsken ind i atmosfæren.
* salte: Mens opløseligheden af de fleste salte øges med temperaturen, er der nogle undtagelser. For eksempel falder opløseligheden af lithiumsulfat med stigende temperatur.
Faktorer, der påvirker opløselighed:
* arten af opløst stof og opløsningsmiddel: Polære opløste stoffer opløses bedst i polære opløsningsmidler, og ikke-polære opløste stoffer opløses bedst i ikke-polære opløsningsmidler.
* tryk: Tryk har en betydelig effekt på opløseligheden af gasser, men en ubetydelig effekt på opløseligheden af faste stoffer og væsker.
* Partikelstørrelse: Mindre partikler af opløst stof opløses hurtigere end større partikler.
Kortfattet:
Mens der er undtagelser, øges opløseligheden af de fleste stoffer med en stigning i temperaturen på grund af øget kinetisk energi og svækkelse af intermolekylære kræfter.
Sidste artikelStiger opløseligheden, når temperaturen øges?
Næste artikelHvordan kan du ændre opløseligheden af et opløst stof?
 Varme artikler
Varme artikler
-
 Frigør potentialet for metalnanopartikler som katalysatorer for hurtig og effektiv CO2-omdannelseNano-arkitektur:nikkelpartikler præcis 1/40, 000. på størrelse med et menneskehår er de bedste katalysatorer til omdannelse af CO2. Kredit:Utrecht University / Uorganisk kemi og katalyse O 2 og
Frigør potentialet for metalnanopartikler som katalysatorer for hurtig og effektiv CO2-omdannelseNano-arkitektur:nikkelpartikler præcis 1/40, 000. på størrelse med et menneskehår er de bedste katalysatorer til omdannelse af CO2. Kredit:Utrecht University / Uorganisk kemi og katalyse O 2 og -
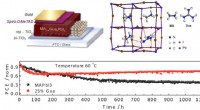 Guanidinium stabiliserer perovskit-solceller med en effektivitet på 19 procentStabilitetstest af det nye MA(1-x)GuaxPbI3 perovskitmateriale under kontinuerlig lysbelysning sammenlignet med det avancerede MAPbI3. Et skematisk billede af enhedsarkitekturen og den simulerede kryst
Guanidinium stabiliserer perovskit-solceller med en effektivitet på 19 procentStabilitetstest af det nye MA(1-x)GuaxPbI3 perovskitmateriale under kontinuerlig lysbelysning sammenlignet med det avancerede MAPbI3. Et skematisk billede af enhedsarkitekturen og den simulerede kryst -
 Maskinlæringshjælpemidler i materialedesignForskere udviklede en maskinlæringsalgoritme til at forudsige 3D molekylær krystaldensitet ud fra 2D kemiske strukturer. Kredit:Lawrence Livermore National Laboratory Et langvarigt mål af kemikere
Maskinlæringshjælpemidler i materialedesignForskere udviklede en maskinlæringsalgoritme til at forudsige 3D molekylær krystaldensitet ud fra 2D kemiske strukturer. Kredit:Lawrence Livermore National Laboratory Et langvarigt mål af kemikere -
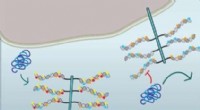 Den hemmelige sulfatkode, der lader den dårlige Tau indFiguren viser, at cellulær taufibriloptagelse kræver 6-O-sulfatering og N-sulfatering af HSPG-sidekæderne:Cellen i den nederste halvdel udtrykker HSPGer med alle sulfatgrupperne og internaliserer tau
Den hemmelige sulfatkode, der lader den dårlige Tau indFiguren viser, at cellulær taufibriloptagelse kræver 6-O-sulfatering og N-sulfatering af HSPG-sidekæderne:Cellen i den nederste halvdel udtrykker HSPGer med alle sulfatgrupperne og internaliserer tau
- Beregningskemi understøtter forskning i nye halvlederteknologier
- Israel gik først til at lande rumfartøjer på månen
- Trofiske niveauer af koralrev
- Når et lys er tændt, gennemgår det kemisk forandring?
- Gør ekstremt tynde smørende film forudsigelige:Udvidelse af Reynolds-ligningen med en ikke-lineær…
- Hvad er et dørstop et eksempel på i videnskab?


