Er SO3 en Lewis -base eller syre?
* Lewis -syrer: Accepter elektronpar.
* Lewis -baser: Doner elektronpar.
Strukturen af SO3:
Svovltrioxid (SO3) har et centralt svovlatom dobbeltbundet til tre iltatomer. Svovlatomet har en tom d orbital, hvilket gør det i stand til at acceptere elektronpar.
hvordan SO3 fungerer som en Lewis -syre:
* Elektronmangel: Svovlatomet i SO3 har en formel ladning på +2 på grund af dobbeltbindingerne med ilt. Denne positive ladning indikerer en mangel på elektroner.
* tom orbital: Svovlatomet har en tom d orbital. Denne tomme orbital kan let acceptere et elektronpar fra en Lewis -base.
Eksempel:
Når SO3 reagerer med vand (H2O), fungerer det som en Lewis -syre:
SO3 + H2O → H2SO4
I denne reaktion donerer iltatomet i vand et elektronpar til svovlatomet i SO3, danner en ny binding og skaber svovlsyre (H2SO4).
Sidste artikelHvordan kan ufuldstændig forbrænding forekomme i en gaskedel?
Næste artikelEr Alcl3 Lewis Acid eller Base?
 Varme artikler
Varme artikler
-
 Indkapslede proteinoscillationer forårsager dynamiske membrandeformationer i cellerComputergenereret afbildning af proteinholdige kæmpe vesikler. Kredit:Thomas Litschel/MPI fra Biochemistry Hvilke kriterier skal en syntetisk skabt celle opfylde for at blive betragtet som levende
Indkapslede proteinoscillationer forårsager dynamiske membrandeformationer i cellerComputergenereret afbildning af proteinholdige kæmpe vesikler. Kredit:Thomas Litschel/MPI fra Biochemistry Hvilke kriterier skal en syntetisk skabt celle opfylde for at blive betragtet som levende -
 Forskere anvender kemiske værktøjer til at opdage kræftfremkaldende proteinerYekaterina Kovalyova. Kredit:Yale University Forskere ved Yales Microbial Sciences Institute har taget et vigtigt skridt i vores forståelse af, hvordan infektion ændrer proteiner på en måde, der fr
Forskere anvender kemiske værktøjer til at opdage kræftfremkaldende proteinerYekaterina Kovalyova. Kredit:Yale University Forskere ved Yales Microbial Sciences Institute har taget et vigtigt skridt i vores forståelse af, hvordan infektion ændrer proteiner på en måde, der fr -
 Ny metode til 3D-print af metalopfangningsfiltre til selektivt at adskille ædelmetaller fra affald …Kredit:CC0 Public Domain Dagens omfattende brug af højteknologiske metaller har ført til øget forsyningspres mod metalkilder. Dette har vakt interesse for at udvikle nye teknikker til metalopfangn
Ny metode til 3D-print af metalopfangningsfiltre til selektivt at adskille ædelmetaller fra affald …Kredit:CC0 Public Domain Dagens omfattende brug af højteknologiske metaller har ført til øget forsyningspres mod metalkilder. Dette har vakt interesse for at udvikle nye teknikker til metalopfangn -
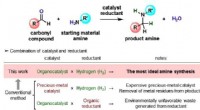 Nærmer sig en ideel aminosyresyntese ved hjælp af hydrogenFigur 1. Generelt skema for katalytisk reduktiv alkylering af aminer. Kredit:Osaka University Osaka Universitets forskere demonstrerede en reduktiv alkyleringsmetode til funktionalisering af subst
Nærmer sig en ideel aminosyresyntese ved hjælp af hydrogenFigur 1. Generelt skema for katalytisk reduktiv alkylering af aminer. Kredit:Osaka University Osaka Universitets forskere demonstrerede en reduktiv alkyleringsmetode til funktionalisering af subst


