Former svovl og ilt ioniske bindinger?
* Elektronegativitet: Oxygen er meget mere elektronegativ end svovl. Dette betyder, at ilt har et stærkere træk på elektroner. Mens forskellen i elektronegativitet ikke er så stor som i klassiske ioniske forbindelser, er den stadig betydelig nok til at føre til en polær kovalent binding . Dette betyder, at elektronerne deles ulige, hvor ilt har en lidt negativ ladning og svovl med en lidt positiv ladning.
* iondannelse: For at danne en ionisk binding skal det ene element let miste elektroner (danne en positiv ion), og den anden skal let få elektroner (danne en negativ ion). Svovl og ilt er, mens de har forskelle i elektronegativitet, begge ikke -metaller og danner ikke let ioner på denne måde.
Eksempler:
* svovldioxid (SO2): Dette molekyle har to polære kovalente bindinger mellem svovl og hvert iltatom.
* svovltrioxid (SO3): Dette molekyle har tre polære kovalente bindinger mellem svovl og hvert iltatom.
Kortfattet: Mens der er forskel i elektronegativitet mellem svovl og ilt, er den resulterende binding en polær kovalent binding, ikke en ionisk binding.
Sidste artikelDanner kulstof normalt ioniske bindinger?
Næste artikelFormer polonium ioniske eller kovalente bindinger?
 Varme artikler
Varme artikler
-
 Opdagelsen af nye forbindelser til handling på døgnrytmenNye små molekyler KL101 og TH301 mål CRY1 og CRY2, henholdsvis, at styre døgnrytmen. Kredit:Issey Takahashi | ITBM, Nagoya Universitet Døgnets ur styrer en række biologiske fænomener, der opstår i
Opdagelsen af nye forbindelser til handling på døgnrytmenNye små molekyler KL101 og TH301 mål CRY1 og CRY2, henholdsvis, at styre døgnrytmen. Kredit:Issey Takahashi | ITBM, Nagoya Universitet Døgnets ur styrer en række biologiske fænomener, der opstår i -
 Ny teknik til at karakterisere kemisk sammensætning og struktur af prøverKredit:Forance, Shutterstock Raman -spektroskopi er en væsentlig teknik, der bruges til undersøgelse af materialer - herunder nanostrukturer - og biologiske systemer til at analysere deres sammens
Ny teknik til at karakterisere kemisk sammensætning og struktur af prøverKredit:Forance, Shutterstock Raman -spektroskopi er en væsentlig teknik, der bruges til undersøgelse af materialer - herunder nanostrukturer - og biologiske systemer til at analysere deres sammens -
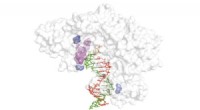 En ny rettet evolutionsteknik til at frigøre potentialet for xeno-nukleinsyrerDiagram, der viser den omvendte transkriptasestruktur (hvid) med spirende cDNA -streng (rød), XNA -skabelon (grøn) og områder kritiske for omvendt transkription af XNA -skabeloner (blå og lilla). Kred
En ny rettet evolutionsteknik til at frigøre potentialet for xeno-nukleinsyrerDiagram, der viser den omvendte transkriptasestruktur (hvid) med spirende cDNA -streng (rød), XNA -skabelon (grøn) og områder kritiske for omvendt transkription af XNA -skabeloner (blå og lilla). Kred -
 Forskere designer lovende ny katode til natriumbaserede batterierXiao-Qing Yang (til venstre) og Enyuan Hu (i midten) af Brookhavens kemiafdeling, afbildet med strålefysiker Eli Stavitski (til højre) ved ISS strålelinje ved NSLS-II. Kredit:Brookhaven National Labor
Forskere designer lovende ny katode til natriumbaserede batterierXiao-Qing Yang (til venstre) og Enyuan Hu (i midten) af Brookhavens kemiafdeling, afbildet med strålefysiker Eli Stavitski (til højre) ved ISS strålelinje ved NSLS-II. Kredit:Brookhaven National Labor
- Midt i ramaskrig over Facebooks privatlivsproblemer, nye tilgange er nødvendige for at beskytte for…
- Hvorfor kan prøver af guld og kobber have de samme sæt fysiske egenskaber, men ikke kemiske egensk…
- Smartphone-skærmteknologi bruges til at narre skadelige bakterier
- Vil vi nogensinde reducere vores afhængighed af udenlandsk olie?
- Om Varmeforurening
- Brug af Einsteins teblads paradoks til at studere nanovæsker


