Hvad er sandt, når du sammenligner 2p og 3p orbitaler?
Nøgleforskelle:
* Energiniveau: 3P -orbitaler er på et højere energiniveau end 2p -orbitaler. Dette betyder, at elektroner i 3p orbitaler har mere energi.
* størrelse: 3p orbitaler er større end 2p orbitaler. Elektronerne i 3p -orbitaler er i gennemsnit længere væk fra kernen.
* antal noder: 2p orbitaler har en knude (en region, hvor sandsynligheden for at finde en elektron er nul), mens 3p orbitaler har to noder. Disse knudepunkter er regioner med nul elektrondensitet.
* form: Både 2p og 3p orbitaler har en håndvægtform. Imidlertid er 3P -orbitaler mere komplekse på grund af den ekstra knude.
Hvad er sandt:
* Elektroner i 3p orbitaler har et højere energiniveau.
* 3p orbitaler er større end 2p orbitaler.
* 3p orbitaler har flere knudepunkter end 2p orbitaler.
* Både 2p og 3p orbitaler har en håndvægtform.
Kortfattet:
Forskellen mellem 2p og 3p orbitaler ligger primært i deres energiniveau og størrelser. Dette er en konsekvens af, at elektronerne i 3p orbitaler er længere væk fra kernen.
Sidste artikelHvad er pH for nitrogenoxid?
Næste artikelHvilken form har molekylet clf2 plus?
 Varme artikler
Varme artikler
-
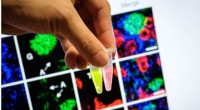 Forskere udvikler sonder til at opdage akut nyresvigt tidligtSonderne, når det tilsættes en urinprøve med biomarkører, der indikerer begyndelsen af akut nyresvigt, lyser, når de udsættes for UV-lys. De gør det 36 timer hurtigere end andre molekylære billeddan
Forskere udvikler sonder til at opdage akut nyresvigt tidligtSonderne, når det tilsættes en urinprøve med biomarkører, der indikerer begyndelsen af akut nyresvigt, lyser, når de udsættes for UV-lys. De gør det 36 timer hurtigere end andre molekylære billeddan -
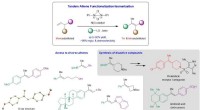 Stereoselektiv alkensyntese med ikke-ædel nikkelkatalyseSkematisk, der viser udviklingen af et nyt Ni-katalyseret system, der konverterer billige og let tilgængelige monosubstituerede olefiner til højværdi tri- og tetrasubstituerede analoger, og dets anv
Stereoselektiv alkensyntese med ikke-ædel nikkelkatalyseSkematisk, der viser udviklingen af et nyt Ni-katalyseret system, der konverterer billige og let tilgængelige monosubstituerede olefiner til højværdi tri- og tetrasubstituerede analoger, og dets anv -
 Ny svampedræbende forbindelse fra myrfarmeKredit:CC0 Public Domain Attmyrer er landmænd, og de dyrker svamp som føde. Pseudonocardia og Streptomyces bakterier er deres gårdmænd, producerer metabolitter, der beskytter afgrøden mod patogene
Ny svampedræbende forbindelse fra myrfarmeKredit:CC0 Public Domain Attmyrer er landmænd, og de dyrker svamp som føde. Pseudonocardia og Streptomyces bakterier er deres gårdmænd, producerer metabolitter, der beskytter afgrøden mod patogene -
 Faraday stoffer? MXene-belagt stof kan indeholde elektronisk interferens i bærbare enhederDrexel University-forskere rapporterer, at stof belagt med MXene er 99,9 % effektivt til at blokere elektromagnetisk interferens. Kredit:Drexel University Forskere ved Drexel Universitys College o
Faraday stoffer? MXene-belagt stof kan indeholde elektronisk interferens i bærbare enhederDrexel University-forskere rapporterer, at stof belagt med MXene er 99,9 % effektivt til at blokere elektromagnetisk interferens. Kredit:Drexel University Forskere ved Drexel Universitys College o
- Hvordan ligner en chloroplast bakterien?
- Er CO2 en polær eller ikke -type?
- Tørke, brand og oversvømmelse:Hvordan ydre byområder kan håndtere nødsituationer og samtidig re…
- Hvad har vi lært af Human Genome Project?
- Biogene sedimenter er skaller og skeletter af marine dyr alger Hvilke to eksempler på dette?
- Mennesker eller profit? Facebook-aviser viser dyb konflikt inden for


