Hvilken form har molekylet clf2 plus?
Her er hvorfor:
* Centralatom: Chlor (CL) er det centrale atom.
* Valenselektroner: Chlor har 7 valenselektroner, og hver fluor (F) har 7. Da molekylet har en +1 ladning, trækker vi en elektron. Dette giver os i alt 20 valenselektroner til at distribuere.
* binding: To enkeltbindinger dannes mellem klor og hvert fluoratom ved hjælp af 4 elektroner.
* Ensomme par: De resterende 16 elektroner distribueres som ensomme par på klor- og fluoratomer. Chlor har 3 ensomme par, og hvert fluoratom har 3 ensomme par.
* molekylær geometri: I henhold til VSEPR -teorien resulterer to bindingspar og tre ensomme par rundt i det centrale atom i en lineær form.
Derfor har Clf₂⁺ -molekylet en lineær form med en bindingsvinkel på 180 grader.
Sidste artikelHvad er sandt, når du sammenligner 2p og 3p orbitaler?
Næste artikelHvad er C2 H5 OH?
 Varme artikler
Varme artikler
-
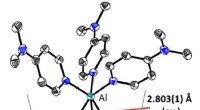 Vigtig milepæl på vejen mod overgangsmetalkatalyse med aluminiumKredit:Albert-Ludwigs-Universität Freiburg im Breisgau Kemikerne Philipp Dabringhaus, Julie Willrett og Prof. Dr. Ingo Krossing fra Institut for Uorganisk og Analytisk Kemi ved Universitetet i Frei
Vigtig milepæl på vejen mod overgangsmetalkatalyse med aluminiumKredit:Albert-Ludwigs-Universität Freiburg im Breisgau Kemikerne Philipp Dabringhaus, Julie Willrett og Prof. Dr. Ingo Krossing fra Institut for Uorganisk og Analytisk Kemi ved Universitetet i Frei -
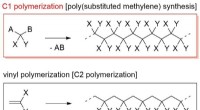 Udvikling af nye smarte bløde materialer:Syntese af en pH-reagerende dendroniseret poly(substituere…Vinylpolymerisation og C1-polymerisation. Kredit:Ehime Unisity C1-polymerisation er en nyttig teknik til fremstilling af polymerer med en carbon-carbon-hovedkæde. Denne teknik konstruerer en polym
Udvikling af nye smarte bløde materialer:Syntese af en pH-reagerende dendroniseret poly(substituere…Vinylpolymerisation og C1-polymerisation. Kredit:Ehime Unisity C1-polymerisation er en nyttig teknik til fremstilling af polymerer med en carbon-carbon-hovedkæde. Denne teknik konstruerer en polym -
 Forsker udvikler metode til at ændre fundamental arkitektur af polymererAdjunkt Justin Kennemur og kandidatstuderende Taylor Isais er medforfattere på en ny undersøgelse om, hvordan man ændrer den grundlæggende struktur af en polymer. Kredit:Bruce Palmer/FSU Et forskn
Forsker udvikler metode til at ændre fundamental arkitektur af polymererAdjunkt Justin Kennemur og kandidatstuderende Taylor Isais er medforfattere på en ny undersøgelse om, hvordan man ændrer den grundlæggende struktur af en polymer. Kredit:Bruce Palmer/FSU Et forskn -
 Aluminiumgenbrugsteknologi boostet af krystalliseringsforskningUnder påvirkning af magnetisk omrøring, spiralformede skruelignende krystaller dannes i smeltet legering. Kredit:Dr. Biao Cai En innovativ metode til genanvendelse af aluminium er blevet styrket a
Aluminiumgenbrugsteknologi boostet af krystalliseringsforskningUnder påvirkning af magnetisk omrøring, spiralformede skruelignende krystaller dannes i smeltet legering. Kredit:Dr. Biao Cai En innovativ metode til genanvendelse af aluminium er blevet styrket a
- Hvad måler specifik tyngdekraft?
- Udfordringen med at bygge et massivt rumteleskop
- Hvad er det molekylære navn for AL2BR6?
- Undersøgelse afslører et kæmpe lager af global kulstof fra jorden
- Hvordan hjælper DNA med at opretholde homeostase?
- Mod selvgendannende elektroniske enheder med lange DNA-molekyler


