Hvad sker der med vand, hvis du lægger salt i det?
1. Opløsning:
* Salt (natriumchlorid) er et krystallinsk fast stof. Når du lægger det i vand, omgiver vandmolekylerne saltkrystallerne.
* De positive ender af vandmolekyler (hydrogenatomer) tiltrækkes af de negativt ladede chloridioner i saltet.
* De negative ender af vandmolekyler (iltatomer) tiltrækkes af de positivt ladede natriumioner i saltet.
* Denne attraktion bryder bindingerne, der holder saltkrystallerne sammen, hvilket får dem til at opløses.
2. Løsningsdannelse:
* De opløste saltioner (natrium og chlorid) bliver omgivet af vandmolekyler og danner en opløsning.
* Opløsningen er nu en homogen blanding, hvilket betyder, at saltet er jævnt fordelt over vandet.
3. Ændringer i egenskaber:
* kogepunkt: Vandets kogepunkt øges. Jo mere salt du tilføjer, jo højere er kogepunktet.
* frysningspunkt: Vandets frysepunkt falder. Jo mere salt du tilføjer, jo lavere frysepunktet.
* densitet: Vandets densitet øges. Salt vand er tættere end ferskvand.
* Konduktivitet: Opløsningen bliver elektrisk ledende, fordi de opløste ioner kan bære en elektrisk strøm.
Kortfattet:
Tilsætning af salt til vand får saltet til at opløses, hvilket skaber en opløsning med forskellige egenskaber sammenlignet med rent vand.
Sidste artikelHvilket element med ti 4D -elektroner i periode 5?
Næste artikelHvad er den ædle gaskonfiguration af bor?
 Varme artikler
Varme artikler
-
 Spytproteiner kunne forklare, hvorfor nogle mennesker bruger for meget saltKredit:American Chemical Society Mange amerikanere indtager for meget salt. Nu i en undersøgelse, der vises i Journal of Agricultural and Food Chemistry , forskere rapporterer, at mennesker, der
Spytproteiner kunne forklare, hvorfor nogle mennesker bruger for meget saltKredit:American Chemical Society Mange amerikanere indtager for meget salt. Nu i en undersøgelse, der vises i Journal of Agricultural and Food Chemistry , forskere rapporterer, at mennesker, der -
 Forskere udvikler antibakteriel gelbandage ved hjælp af durian-skallerForskellige størrelser af det durian-afledte hydrogelplaster, hvor den kan gøres stor til operationssår eller klippes mindre til typisk bandagestørrelse. Kredit:Nanyang Technological University Fø
Forskere udvikler antibakteriel gelbandage ved hjælp af durian-skallerForskellige størrelser af det durian-afledte hydrogelplaster, hvor den kan gøres stor til operationssår eller klippes mindre til typisk bandagestørrelse. Kredit:Nanyang Technological University Fø -
 Væske-væske faseadskillelse fundet at drive processen med at konvertere spidroin-proteiner til edd…Forsuring udløser hurtig selvsamling af MaSp2 nanofibriller. (A) N-R12-C mærket med DyLight 488 (10 til 20 mg ml-1 slutkoncentration) blev blandet ind i 0,5 M KPi ved de angivne pH-værdier og visualis
Væske-væske faseadskillelse fundet at drive processen med at konvertere spidroin-proteiner til edd…Forsuring udløser hurtig selvsamling af MaSp2 nanofibriller. (A) N-R12-C mærket med DyLight 488 (10 til 20 mg ml-1 slutkoncentration) blev blandet ind i 0,5 M KPi ved de angivne pH-værdier og visualis -
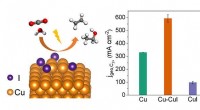 Ny katalysator øger kuldioxid elektroreduktion til multicarbon-produkterEn Cu-CuI-kompositkatalysator opnår højeffektiv produktion af C 2 + kemikalier fra elektrokatalytisk CO 2 reduktion. Kredit:LI Hefei og LIU Tianfu Elektrokatalytisk CO 2 reduktionsreaktion
Ny katalysator øger kuldioxid elektroreduktion til multicarbon-produkterEn Cu-CuI-kompositkatalysator opnår højeffektiv produktion af C 2 + kemikalier fra elektrokatalytisk CO 2 reduktion. Kredit:LI Hefei og LIU Tianfu Elektrokatalytisk CO 2 reduktionsreaktion
- Hvilken kraft skubber luftmasser og skyer fra havet mod land?
- Observationer udforsker karakteren af den sammensmeltende dværggalakse VCC 322
- Gestationsperioder for fugle
- Hvad er tyngdekraften, der virker på en bold, der har masse 50 kg?
- Er det sandsynligt, at oleinsyre er en væske ved stuetemperatur?
- 30.000 liv kunne reddes ved at reducere luftforureningsniveauet under den nuværende standard


