Hvilket element er mere tilbøjeligt til at reagere med iltnatrium eller calcium, forklar, om du kan takke dig?
* ioniseringsenergi: Calcium har en lavere ioniseringsenergi end natrium. Dette betyder, at det kræver mindre energi for at fjerne et elektron fra et calciumatom sammenlignet med et natriumatom. En lavere ioniseringsenergi gør det lettere for calcium at danne en positiv ion og deltage i en reaktion med ilt.
* Elektropositivitet: Calcium er mere elektropositiv end natrium, hvilket betyder, at det har en større tendens til at miste elektroner og danne en positiv ion. Dette gør det igen mere reaktivt med ilt.
* reaktivitetsserie: Calcium er placeret under natrium i reaktivitetsserien af metaller. Dette betyder, at calcium er mere reaktiv end natrium.
Reaktionsprodukter:
* natrium: Natrium reagerer med ilt til dannelse af natriumoxid (Na₂O), som yderligere kan reagere med vand til dannelse af natriumhydroxid (NaOH).
* calcium: Calcium reagerer med ilt til dannelse af calciumoxid (CAO), også kendt som QuickLime. Denne reaktion er meget eksoterm og producerer et skarpt lys.
Kortfattet: Både natrium og calcium er meget reaktive med ilt, men calcium er lidt mere tilbøjelig til at reagere på grund af dens lavere ioniseringsenergi, større elektropositivitet og højere position i reaktivitetsserien.
Sidste artikelEr opløsning i vand en kemisk eller fysisk egenskab?
Næste artikelHvad er forskellen mellem at opløse ilt og ilt?
 Varme artikler
Varme artikler
-
 Identifikation af en ny, renere kilde til hvidt lysVed bestråling med infrarødt lys dannes adamantan-baserede molekylære klynger med den generelle sammensætning [(RT)4E5] (med R =organisk gruppe; T =C, Si, Ge, Sn; E =O, S, Se, Te, NH, CH2 , ON•) udsen
Identifikation af en ny, renere kilde til hvidt lysVed bestråling med infrarødt lys dannes adamantan-baserede molekylære klynger med den generelle sammensætning [(RT)4E5] (med R =organisk gruppe; T =C, Si, Ge, Sn; E =O, S, Se, Te, NH, CH2 , ON•) udsen -
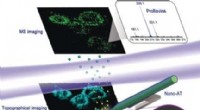 Kemisk og topografisk enkeltcelle-billeddannelse ved opløsning i nanoskala ved nærfeltsdesorptions…Kredit:Wiley Hvordan er kemikalier fordelt i en celle? Kinesiske videnskabsmænd har udviklet en kombineret massespektrometri og biologisk billeddannelsesenhed, der muliggør direkte, mærkefri påvis
Kemisk og topografisk enkeltcelle-billeddannelse ved opløsning i nanoskala ved nærfeltsdesorptions…Kredit:Wiley Hvordan er kemikalier fordelt i en celle? Kinesiske videnskabsmænd har udviklet en kombineret massespektrometri og biologisk billeddannelsesenhed, der muliggør direkte, mærkefri påvis -
 Forskere udvikler nye gennemsigtige bredbånds elektromagnetiske interferensafskærmningsmaterialerFig. Prøverne af gennemsigtige EMI -afskærmningsmaterialer fremstillet gennem (a) et laboratoriefacilitet og (b) et pilotanlæg. Kredit:NIMTE Den fleksible optoelektroniske materialegruppe ledet af
Forskere udvikler nye gennemsigtige bredbånds elektromagnetiske interferensafskærmningsmaterialerFig. Prøverne af gennemsigtige EMI -afskærmningsmaterialer fremstillet gennem (a) et laboratoriefacilitet og (b) et pilotanlæg. Kredit:NIMTE Den fleksible optoelektroniske materialegruppe ledet af -
 Bakterieovertrukne nanofiberelektroder fordøjer forurenende stofferCarbon nanofibre belagt med PEDOT i et scanning elektronmikroskop billede. Kredit:Juan Guzman og Meryem Pehlivaner/Provided Cornell-materialeforskere og bioelektrokemiske ingeniører kan have skabt
Bakterieovertrukne nanofiberelektroder fordøjer forurenende stofferCarbon nanofibre belagt med PEDOT i et scanning elektronmikroskop billede. Kredit:Juan Guzman og Meryem Pehlivaner/Provided Cornell-materialeforskere og bioelektrokemiske ingeniører kan have skabt


