Hvad skal kemiske reaktioner, der absorberer energi, ske?
* varme: Den mest almindelige måde at give energi til en endotermisk reaktion er ved at opvarme reaktanterne. Dette øger molekylernes kinetiske energi, hvilket gør dem mere tilbøjelige til at kollidere og overvinde aktiveringsenergibarrieren.
* lys: Nogle reaktioner er drevet af absorptionen af lysenergi, som fotosyntesen, hvor sollys giver energien til at omdanne kuldioxid og vand til glukose.
* Elektricitet: Elektrolyse bruger elektrisk energi til at nedbryde kemiske forbindelser, såsom nedbrydning af vand til brint og ilt.
Her er en simpel analogi:Forestil dig at skubbe en tung klippe op ad bakke. Du skal sætte energi i systemet (din indsats) for at flytte klippen op ad bakke. Tilsvarende har endotermiske reaktioner brug for energiindgang for at fortsætte.
Nøglekoncepter:
* Aktiveringsenergi: Den mindste mængde energi, der kræves for reaktanter, til at omdanne til produkter. Endotermiske reaktioner har en højere aktiveringsenergi end eksoterme reaktioner.
* entalpiændring: Et mål for varmeændringen i en reaktion. For endotermiske reaktioner er enthalpiændringen positiv, hvilket indikerer, at varme absorberes.
Eksempler på endotermiske reaktioner:
* Meltis: Absorber varme for at bryde bindingerne mellem vandmolekyler.
* Fotosyntese: Planter absorberer lysenergi til at omdanne kuldioxid og vand til glukose.
* bagning af en kage: Batteren absorberer varmeenergi til at koge og omdannes til en kage.
Fortæl mig, hvis du har flere spørgsmål!
 Varme artikler
Varme artikler
-
 Gennembrud for retshåndhævelse til hurtigt at skelne mellem hamp og kontrolleret marihuanaHamp Synergistics, LLC, en bioteknologivirksomhed dedikeret til at transformere den måde, forbrugerne bruger hamp-afledte cannabinoid-baserede formuleringer, har dannet et partnerskab med førende rets
Gennembrud for retshåndhævelse til hurtigt at skelne mellem hamp og kontrolleret marihuanaHamp Synergistics, LLC, en bioteknologivirksomhed dedikeret til at transformere den måde, forbrugerne bruger hamp-afledte cannabinoid-baserede formuleringer, har dannet et partnerskab med førende rets -
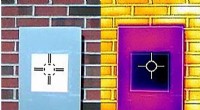 Den hvideste maling er her - og den er den sejeste. Bogstaveligt talt.Et infrarødt kamera viser, hvordan en prøve af den hvideste hvide maling (den mørke lilla firkant i midten) faktisk afkøler brættet under omgivelsestemperatur, noget, som ikke engang kommercielle varm
Den hvideste maling er her - og den er den sejeste. Bogstaveligt talt.Et infrarødt kamera viser, hvordan en prøve af den hvideste hvide maling (den mørke lilla firkant i midten) faktisk afkøler brættet under omgivelsestemperatur, noget, som ikke engang kommercielle varm -
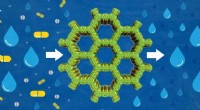 Nye molekylsigterMolekylsigter er nyttige i mange industrielle processer, især inden for kemi- og energisektoren. Kredit:University of Delaware Et internationalt team af forskere har for nylig syntetiseret polyary
Nye molekylsigterMolekylsigter er nyttige i mange industrielle processer, især inden for kemi- og energisektoren. Kredit:University of Delaware Et internationalt team af forskere har for nylig syntetiseret polyary -
 Sådan bliver en badesvamp til et biobaseret industrielt filterProfessor Hermann Ehrlich ser på et stykke af det nye materiale. Kredit:TU Bergakademie Freiberg / C. Mokry Forskere ved TU Bergakademie Freiberg udviklede et innovativt materiale fra en dyrket ma
Sådan bliver en badesvamp til et biobaseret industrielt filterProfessor Hermann Ehrlich ser på et stykke af det nye materiale. Kredit:TU Bergakademie Freiberg / C. Mokry Forskere ved TU Bergakademie Freiberg udviklede et innovativt materiale fra en dyrket ma
- Al energi i biosfæren kommer fra Sun True eller False?
- Kina siger, at nogle fabrikker har overtrådt anti-smog-foranstaltninger
- Hvordan iskapper kollapser - en lære fra fortiden
- Hvorfor er sommerfugle vigtige?
- Forskere printer solceller på toiletpapir, andre sarte materialer (med video)
- Månen og synlige planeter er altid inden for et par grader af ekliptikken?


