Hvorfor er der en attraktion mellem natrium- og klorioner?
* natrium (NA) mister en elektron: Natriumatomer har et elektron i deres yderste skal. De mister let dette elektron for at opnå en stabil, fuld ydre skal. Dette tab af et elektron gør natrium til en positivt ladet ion (Na+).
* klor (CL) får en elektron: Kloratomer har syv elektroner i deres yderste skal. De får let et elektron for at opnå en stabil, fuld ydre skal. Denne forstærkning af en elektron gør klor til en negativt ladet ion (CL-).
Modsatte afgifter tiltrækker: Nu har du en positivt ladet natriumion (Na+) og en negativt ladet chlorion (Cl-). Da modsatte anklager tiltrækkes, trækkes disse ioner til hinanden.
ionisk binding: Denne stærke elektrostatiske attraktion mellem de modsatte ladede ioner kaldes en ionisk binding . Det danner grundlaget for det forbindelsesnatriumchlorid (NaCl), almindeligt kendt som bordsalt.
nøglepunkter at huske:
* Elektrostatiske kræfter: Tiltrækningen mellem natrium- og klorioner er baseret på det grundlæggende princip for elektrostatiske kræfter, hvor modsatte afgifter tiltrækker.
* stabil konfiguration: Tabet og forstærkningen af elektroner tillader både natrium og klor at opnå en stabil, fuld ydre skal, som er en nøglefaktor i kemisk binding.
* ionisk sammensat dannelse: Den stærke tiltrækning mellem ionerne resulterer i dannelsen af en stabil ionisk forbindelse, natriumchlorid.
 Varme artikler
Varme artikler
-
 Fanget på fersk gerning:Billeder fanger molekylære bevægelser i realtidForskere afbildede subtile bevægelser af et molekyle kendt som N-methylmorpholin, når det blev exciteret af UV-lys. Kredit:Brown University / SLAC Forskere har brugt ultra-højhastigheds røntgenimp
Fanget på fersk gerning:Billeder fanger molekylære bevægelser i realtidForskere afbildede subtile bevægelser af et molekyle kendt som N-methylmorpholin, når det blev exciteret af UV-lys. Kredit:Brown University / SLAC Forskere har brugt ultra-højhastigheds røntgenimp -
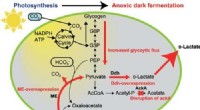 Metoden giver høj mængde af D-lactat ved hjælp af cyanobakterier, kunne revolutionere produktione…Figur 1:Vejen til omdannelse af kuldioxid til D-laktat. Synechocystis sp. PCC 6803 producerer glykogen inde i sine celler fra CO2 og lys. Det blev afsløret, at når Synechocystis sp. PCC 6803, der har
Metoden giver høj mængde af D-lactat ved hjælp af cyanobakterier, kunne revolutionere produktione…Figur 1:Vejen til omdannelse af kuldioxid til D-laktat. Synechocystis sp. PCC 6803 producerer glykogen inde i sine celler fra CO2 og lys. Det blev afsløret, at når Synechocystis sp. PCC 6803, der har -
 VTT udvikler gennemsigtig cellulosefilm til at erstatte traditionel plast i fødevareemballageKredit:VTT Technical Research Center of Finland Madpakker opfylder deres vigtigste opgaver, når de beskytter mad og minimerer spild. Tynde plastfilm er alligevel svære at genbruge, og de ender ofte
VTT udvikler gennemsigtig cellulosefilm til at erstatte traditionel plast i fødevareemballageKredit:VTT Technical Research Center of Finland Madpakker opfylder deres vigtigste opgaver, når de beskytter mad og minimerer spild. Tynde plastfilm er alligevel svære at genbruge, og de ender ofte -
 Ingeniører bruger varmefri teknologi til at lave metalliske replikaer af en roses overfladeteksturDenne laboratoriedemonstration viser, hvordan et rosenblad og en metallisk kopi af kronbladets overfladestruktur afviser vand. Replikaen blev skabt ved hjælp af sparsommelig videnskab/innovation fra M
Ingeniører bruger varmefri teknologi til at lave metalliske replikaer af en roses overfladeteksturDenne laboratoriedemonstration viser, hvordan et rosenblad og en metallisk kopi af kronbladets overfladestruktur afviser vand. Replikaen blev skabt ved hjælp af sparsommelig videnskab/innovation fra M
- Hvorfor bruges FECL2 ikke til at identificere phenol?
- Hvilket rumfartøj var først til at udføre en vellykket Lunar Soft Landing?
- Datalagring ved hjælp af individuelle molekyler
- Hvilken af de ydre planeter har ringe?
- Hvordan superbugs bruger spejlbilleder til at skabe antibiotikaresistens
- Hvor lang tid tager det at køre fra Sun Pluto med 112 km i timen?


