Hvordan holdes elektrisk neutralitet i en ionisk forbindelse?
1. Modsatte afgifter tiltrækker:
* Ioniske forbindelser dannes af den elektrostatiske tiltrækning mellem positivt ladede ioner (kationer) og negativt ladede ioner (anioner). Tænk på det som magneter:Modsatte poler tiltrækker!
2. Lige og modsatte afgifter:
* Nøglen til neutralitet er, at den samlede positive ladning fra kationerne nøjagtigt skal svare til den samlede negative ladning fra anionerne. Dette betyder, at antallet af hver type ion, der er til stede i forbindelsen, skal justeres for at opnå denne balance.
3. Eksempel:natriumchlorid (NaCl)
* Natrium (NA) mister en elektron for at blive en +1 -kation (Na +).
* Chlor (CL) får en elektron til at blive en -1 -anion (Cl-).
* Forholdet mellem natrium og klorioner i forbindelsen er 1:1. Dette sikrer, at +1 -ladningen fra natriumionen er nøjagtigt afbalanceret med -1 -ladningen fra klorionen, hvilket resulterer i en neutral forbindelse.
4. Mere komplekse forbindelser:
* For forbindelser med mere komplekse ioner kan forholdet mellem kationer og anioner være anderledes.
* For eksempel danner magnesiumchlorid (MGCL2) i magnesiumchlorid (MGCL2) en +2 -kation (Mg2 +), mens chlor (CL) stadig danner en -1 -anion (Cl-).
* For at opnå neutralitet er der behov for to chloridioner for hver enkelt magnesiumion (Mg2 + + 2Cl- =0).
5. Generelt:
Princippet om elektrisk neutralitet er et grundlæggende koncept inden for kemi. Det forklarer, hvorfor ioniske forbindelser er stabile og let dannes. De afbalancerede ladninger skaber en stærk elektrostatisk attraktion, der holder ionerne sammen i en krystalgitterstruktur.
 Varme artikler
Varme artikler
-
 Efter to timer, solcreme, der indeholder zinkoxid, mister effektivitet, bliver giftig:undersøgelseKredit:Unsplash/CC0 Public Domain Solcreme, der indeholder zinkoxid, en almindelig ingrediens, mister meget af sin effektivitet og bliver giftig efter to timers eksponering for ultraviolet strålin
Efter to timer, solcreme, der indeholder zinkoxid, mister effektivitet, bliver giftig:undersøgelseKredit:Unsplash/CC0 Public Domain Solcreme, der indeholder zinkoxid, en almindelig ingrediens, mister meget af sin effektivitet og bliver giftig efter to timers eksponering for ultraviolet strålin -
 Filtrering af giftig chrom fra vandKredit:Alain Herzog / EPFL Hexavalent chrom fortsætter med at forurene vandkilder rundt om i verden, med en amerikansk virksomhed, der netop blev idømt en bøde i februar for at bringe ansatte i fa
Filtrering af giftig chrom fra vandKredit:Alain Herzog / EPFL Hexavalent chrom fortsætter med at forurene vandkilder rundt om i verden, med en amerikansk virksomhed, der netop blev idømt en bøde i februar for at bringe ansatte i fa -
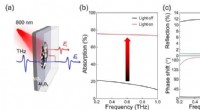 Forskere opfinder bredbånds afstembar terahertz-absorber(a) Skematisk THz-pulsudbredelse gennem VO2-filmen på Al2O3-substratet. (b) Målte ændringen af THz-absorption af VO2-film med og uden lys. (c) Målte ændringen af THz-refleksion og reflektionsfasef
Forskere opfinder bredbånds afstembar terahertz-absorber(a) Skematisk THz-pulsudbredelse gennem VO2-filmen på Al2O3-substratet. (b) Målte ændringen af THz-absorption af VO2-film med og uden lys. (c) Målte ændringen af THz-refleksion og reflektionsfasef -
 Ny hybrid 3D-printteknik vil tilføje en fjerde dimension til additiv fremstillingGrafisk abstrakt. Kredit:DOI:10.1016/j.addma.2021.102337 En ny kemisk proces til additiv fremstilling antyder spændende muligheder for 4D-printede komponenter – såsom egenskaber, der ændrer sig ov
Ny hybrid 3D-printteknik vil tilføje en fjerde dimension til additiv fremstillingGrafisk abstrakt. Kredit:DOI:10.1016/j.addma.2021.102337 En ny kemisk proces til additiv fremstilling antyder spændende muligheder for 4D-printede komponenter – såsom egenskaber, der ændrer sig ov
- Fra Sam-suck til Apple-rival:Samsung-transformationen
- Studiet undersøger, hvordan politisk rapmusik kan påvirke sorte feministiske holdninger
- Hvorfor skulle en videnskabsmand bruge højere kontra lavere procentvis agaroseopløsning, når man …
- Forskning i betydningen af gamle geometriske jordarbejder i det sydvestlige Amazonia
- Fisk den primære ernæringskilde i middelalderens nordlige Østerbotten
- Undersøgelse afslører vigtige kursusfunktioner, der tiltrækker forskellige studerende


