Hvad betyder opløsningsmiddelvidenskab?
* opløsningsmiddel: Det stof, der opløses. Det er normalt til stede i et større beløb end opløsningen.
* opløst: Det stof, der bliver opløst.
* Løsning: Den homogene blanding dannet, når opløsningsmidlet og opløst stoffet kombineres.
Her er en analogi: Forestil dig, at du laver limonade. Vandet er opløsningsmidlet, sukkeret er det opløste stof, og limonaden er selve opløsningen.
Nøgleegenskaber for opløsningsmidler:
* Polaritet: Opløsningsmidler kan være polære eller ikke -polære, afhængigt af deres molekylære struktur. Polære opløsningsmidler (som vand) opløser polære opløste stoffer (som sukker) godt. Ikke -polære opløsningsmidler (som olie) opløser ikke -polære opløste stoffer (som fedt).
* opløselighed: Et opløsningsmiddel til opløsningsmiddel til at opløse et bestemt opløst stof kaldes opløselighed. Forskellige opløsningsmidler har forskellige opløseligheder for forskellige opløste stoffer.
Eksempler på opløsningsmidler:
* Vand: Det mest almindelige opløsningsmiddel, kendt som det "universelle opløsningsmiddel", fordi det opløser mange stoffer.
* alkohol: Brugt i mange kemiske processer og som opløsningsmiddel i mange daglige produkter.
* acetone: Et godt opløsningsmiddel til mange organiske forbindelser, der bruges i neglelakfjerner og andre applikationer.
* hexan: Et ikke -polært opløsningsmiddel, der bruges til ekstraktion af olier og fedt.
At forstå konceptet med opløsningsmidler er afgørende inden for mange videnskabelige områder, herunder:
* Kemi: At forstå kemiske reaktioner og hvordan de forekommer.
* biologi: At studere biologiske processer, der involverer opløsning af stoffer.
* Medicin: At skabe medicin og administrere dem effektivt.
* miljøvidenskab: At forstå virkningen af opløsningsmidler på miljøet.
Sidste artikelHvad kaldes platin i sanskrit?
Næste artikelHvor mange elektronskaller har det største atom?
 Varme artikler
Varme artikler
-
 Forskere simulerer dynamiske bilemissioner ved hjælp af guldnanopartikler til katalyseTre forskellige 3D-repræsentationer af terningformede guldnanopartikler, når de oxiderer kulilte. Dataene viser, at belastningen for det meste forekommer i hjørner og kanter. Kredit:Aline Passos og Fl
Forskere simulerer dynamiske bilemissioner ved hjælp af guldnanopartikler til katalyseTre forskellige 3D-repræsentationer af terningformede guldnanopartikler, når de oxiderer kulilte. Dataene viser, at belastningen for det meste forekommer i hjørner og kanter. Kredit:Aline Passos og Fl -
 Rød, grøn, og blåt lys kan bruges til at kontrollere genekspression i manipuleret E. coliForskere fremstillede farvede billeder på kulturplader ved at bruge røde, grøn, og blåt lys til at kontrollere pigmentet produceret af bakterier med flerfarvesyn. Billedet er blevet farvekorrigeret i
Rød, grøn, og blåt lys kan bruges til at kontrollere genekspression i manipuleret E. coliForskere fremstillede farvede billeder på kulturplader ved at bruge røde, grøn, og blåt lys til at kontrollere pigmentet produceret af bakterier med flerfarvesyn. Billedet er blevet farvekorrigeret i -
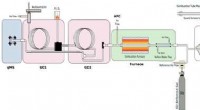 At snuse til rigtige trøflerKredit:American Chemical Society For en pris på tusinder af dollars pr. trøfler er en dyr mad. Svampene er værdsat for deres karakteristiske aroma, og mange fødevarer hævder trøfler eller deres ar
At snuse til rigtige trøflerKredit:American Chemical Society For en pris på tusinder af dollars pr. trøfler er en dyr mad. Svampene er værdsat for deres karakteristiske aroma, og mange fødevarer hævder trøfler eller deres ar -
 Sortering af vira med maskinlæringEnkelte viruspartikeldetekteringer ved hjælp af en solid-state nanopore. Kredit:Osaka University Den igangværende globale pandemi har skabt et presserende behov for hurtige tests, der kan diagnost
Sortering af vira med maskinlæringEnkelte viruspartikeldetekteringer ved hjælp af en solid-state nanopore. Kredit:Osaka University Den igangværende globale pandemi har skabt et presserende behov for hurtige tests, der kan diagnost
- Hvad er de forskellige typer konstellationer, og hvordan varierer de med hensyn til deres dannelse a…
- Udforskning af nye spintronics-enhedsfunktioner i grafen-heterostrukturer
- Hvordan en kæmpe termokandeflaske vil hjælpe med at forstå antimateriale
- Ny forskning understøtter hypotesen om, at asteroide bidrog til masseudryddelse
- Første formørkelse i 99 år, der fejer over Nordamerika
- Hvad er et andet ord for ikke at have energi?


