Hvad hjalp Bohr -modellen med atom med at forklare?
* linjespektre for atomer: Bohr -modellen forklarede, hvorfor atomer kun udsender lys ved specifikke bølgelængder, hvilket skabte de karakteristiske linjespektre, der er observeret i eksperimenter. Det foreslog, at elektroner findes i kvantiserede energiniveau, hvilket betyder, at de kun kan besætte specifikke energitilstande. Når en elektron overgår fra et højere energiniveau til et lavere, frigiver den energi i form af lys med en bestemt bølgelængde.
* Stabilitet af atomer: Bohr -modellen gav en forklaring på stabiliteten af atomer. Det sagde, at elektroner i specifikke kredsløb omkring kernen ikke udstråler energi og modsiger klassisk fysik. Dette var et afgørende skridt i forståelsen af, hvorfor atomer ikke spontant kollapser.
* atomradier: BOHR -modellen gav et grundlag for at forstå de relative størrelser af forskellige atomer. Det forudsagde, at atomer med flere elektroner ville have større radier, fordi elektronerne optager højere energiniveauer længere væk fra kernen.
* ioniseringsenergier: Bohr -modellen tilbød en måde at beregne den energi, der kræves for at fjerne et elektron fra et atom, kendt som ioniseringsenergien. Dette var et vigtigt aspekt ved at forstå kemisk binding og reaktivitet.
Begrænsninger af Bohr -modellen:
Mens en revolutionær model, havde Bohr -modellen begrænsninger:
* Det forklarede ikke de spektrale linjer for multi-elektronatomer.
* Det kunne ikke nøjagtigt forudsige energiniveauet for tungere atomer.
* Det kunne ikke redegøre for den fine struktur af spektrale linjer (små opdelinger i energiniveauet).
* Det gav ikke en komplet forklaring af kemisk binding.
BOHR -modellen blev til sidst erstattet af mere sofistikerede modeller, som den kvantemekaniske model, som gav en mere nøjagtig og omfattende forståelse af atomets struktur og opførsel. Bohr -modellen er dog stadig et værdifuldt værktøj til at forstå de grundlæggende principper for atomstruktur og til at introducere begreberne kvantiserede energiniveauer og elektronkrav.
 Varme artikler
Varme artikler
-
 Simuleringsteknik forudsiger mikrostrukturer af legeringer, der bruges i jetmotorer - før de lavesDen nye First-principles phase field metode til bedre at forudsige komplekse mikrostrukturer af legeringer. Kredit:Yokohama National University Japanske forskere var i stand til hurtigt og præcist
Simuleringsteknik forudsiger mikrostrukturer af legeringer, der bruges i jetmotorer - før de lavesDen nye First-principles phase field metode til bedre at forudsige komplekse mikrostrukturer af legeringer. Kredit:Yokohama National University Japanske forskere var i stand til hurtigt og præcist -
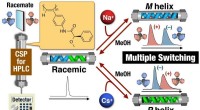 Multi-state omskiftelig stationær fase åbner nye døre i kiral adskillelseSkematisk illustration af tre-tilstands omskiftelig kiral stationær fase baseret på makromolekylær helicitetsmodulering i et poly (phenylacetylen) derivat ved hjælp af metalkationer i søjlen. Kredit:K
Multi-state omskiftelig stationær fase åbner nye døre i kiral adskillelseSkematisk illustration af tre-tilstands omskiftelig kiral stationær fase baseret på makromolekylær helicitetsmodulering i et poly (phenylacetylen) derivat ved hjælp af metalkationer i søjlen. Kredit:K -
 Forskning i perovskit-silicium tandemceller viser ny vej at gåNREL-forskerne Chuanxiao Xiao (til venstre) og Kai Zhu samarbejdede med forskere fra Republikken Korea for at validere potentialet af perovskit-silicium tandem solceller til at opnå mere end 30 % effe
Forskning i perovskit-silicium tandemceller viser ny vej at gåNREL-forskerne Chuanxiao Xiao (til venstre) og Kai Zhu samarbejdede med forskere fra Republikken Korea for at validere potentialet af perovskit-silicium tandem solceller til at opnå mere end 30 % effe -
 Grøn brint:Rust som fotoanode og dens grænserRust ville være et ekstremt billigt og stabilt fotoelektrodemateriale til at producere grøn brint med lys. Men effektiviteten er begrænset. TEM-billedet viser en fotoanode indeholdende et tyndt fotoak
Grøn brint:Rust som fotoanode og dens grænserRust ville være et ekstremt billigt og stabilt fotoelektrodemateriale til at producere grøn brint med lys. Men effektiviteten er begrænset. TEM-billedet viser en fotoanode indeholdende et tyndt fotoak
- Undersøgelse kaster lys over udviklingen af nye modgifte mod nervestoffer
- Forskere opdager, hvordan West Nile-virus overlever i myg
- Evolution i realtid:Hvordan bakterier tilpasser sig deres værter
- Hvad er et naturligt lysshow forårsaget af partikler i luften, der ved ladede solpartikler?
- Teknologi gør byer smarte, men det koster også miljøet
- Svagt baneaffald, der truer satellitter, der ikke overvåges nøje nok, advare astronomer


