Hvad bruger støkiometri til at relatere miles af et molekyle moller en anden?
Sådan fungerer det:
1. afbalanceret kemisk ligning: Koefficienterne i en afbalanceret kemisk ligning repræsenterer antallet af mol af hver reaktant og produkt involveret i reaktionen.
2. molforhold: Forholdet mellem disse koefficienter repræsenterer molforholdet mellem to stoffer i reaktionen.
3. konvertering: Du kan bruge dette molforhold til at konvertere mol af et stof til mol af et andet stof.
Eksempel:
Overvej forbrænding af metan:
Ch₄ + 2o₂ → CO₂ + 2H₂O
* molforhold: Molforholdet mellem methan (CH₄) og kuldioxid (CO₂) er 1:1. Dette betyder for hver 1 mol ch₄ forbruget, 1 mol co₂ produceres.
* konvertering: Hvis du har 2 mol ch₄, kan du beregne molen af co₂ produceret ved at multiplicere med molforholdet:2 mol ch₄ * (1 mol co₂ / 1 mol ch₄) =2 mol co₂
I resumé bruger støkiometri molforholdet, der stammer fra den afbalancerede kemiske ligning til at etablere et kvantitativt forhold mellem molen af forskellige reaktanter og produkter i en kemisk reaktion.
 Varme artikler
Varme artikler
-
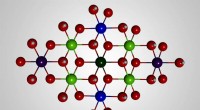 Forskning afslører mekanismen bag en vandspaltningskatalysatorBall-and-stick model af molekylstrukturen af sol-brændstof-katalysatoren udviklet hos Caltech. Blå repræsenterer jernatomer; grøn er nikkel; rød er oxygen; hvid er brint. Kredit:Caltech Caltech-
Forskning afslører mekanismen bag en vandspaltningskatalysatorBall-and-stick model af molekylstrukturen af sol-brændstof-katalysatoren udviklet hos Caltech. Blå repræsenterer jernatomer; grøn er nikkel; rød er oxygen; hvid er brint. Kredit:Caltech Caltech- -
 Plastmarkederne tilpasser sig i en alder af COVID-193D-print af et piggprotein af SARS-CoV-2, virussen, der forårsager COVID-19-foran et 3D-print af en SARS-CoV-2-viruspartikel. Spike -proteinet (forgrunden) gør det muligt for virussen at komme ind og
Plastmarkederne tilpasser sig i en alder af COVID-193D-print af et piggprotein af SARS-CoV-2, virussen, der forårsager COVID-19-foran et 3D-print af en SARS-CoV-2-viruspartikel. Spike -proteinet (forgrunden) gør det muligt for virussen at komme ind og -
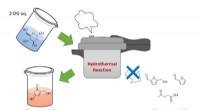 Forskere optimerer metoder til at producere nyttige forbindelser fra biomasseHydrotermisk reaktion under milde forhold. Kredit:Takaaki Kamishima Forskere har identificeret en et-trins proces til omdannelse af et plantebaseret sukker til en kemisk forbindelse, der kan bruge
Forskere optimerer metoder til at producere nyttige forbindelser fra biomasseHydrotermisk reaktion under milde forhold. Kredit:Takaaki Kamishima Forskere har identificeret en et-trins proces til omdannelse af et plantebaseret sukker til en kemisk forbindelse, der kan bruge -
 Modificeret enzym kan øge anden generations ethanolproduktionVed at bruge et protein produceret af en svamp, der lever i Amazonas, Brasilianske forskere udviklede et molekyle, der er i stand til at øge glukosefrigivelsen fra biomasse til fermentering (sukkerrør
Modificeret enzym kan øge anden generations ethanolproduktionVed at bruge et protein produceret af en svamp, der lever i Amazonas, Brasilianske forskere udviklede et molekyle, der er i stand til at øge glukosefrigivelsen fra biomasse til fermentering (sukkerrør
- Hvilke vulkaner er der i Kentucky?
- Forskere løfter sløret for en ny digital tvilling til præcis realtidsanalyse af produktion af kom…
- Hvorfor skal solenergi introduceres i stor skala?
- Er pimpstenhomogen blanding af fast og gas?
- Hvad er altid tab under en overførsel af energi?
- Hvilken del af en hval gør fotosyntesen?


