Hvordan er et molekyle, der har polære bindinger, ikke -polære?
* polære obligationer: En polær binding opstår, når to atomer med forskellige elektronegativitetsselektroner. Dette skaber en delvis positiv ladning på det mindre elektronegative atom og en delvis negativ ladning på det mere elektronegative atom.
* ikke -polære molekyler: Et molekyle er ikke -polært, hvis fordelingen af elektrondensitet er symmetrisk, hvilket betyder, at der ikke er noget samlet dipolmoment.
hvordan symmetri annullerer polaritet:
Forestil dig et molekyle formet som en tetrahedron (som metan, CH4):
1. polære obligationer: Hver C-H-binding er let polær på grund af forskellen i elektronegativitet mellem kulstof og brint.
2. symmetrisk arrangement: De fire polære bindinger er arrangeret symmetrisk omkring det centrale carbonatom. Dette betyder, at de individuelle dipolmomenter i hver binding annullerer hinanden.
3. Intet netto dipolmoment: Da dipolerne annulleres, har molekylet ikke noget samlet dipolmoment og betragtes som ikke -polært.
Eksempel:
* kuldioxid (CO2): Carbon-iltbindingerne er polære, men den lineære form af CO2 sikrer, at dipolmomenterne i de to bindinger annullerer hinanden, hvilket gør molekylet ikke-polært.
Kortfattet: Selv hvis et molekyle har polære bindinger, hvis arrangementet af disse bindinger er symmetrisk, annullerer de individuelle dipolmomenter, hvilket resulterer i et ikke -polært molekyle.
 Varme artikler
Varme artikler
-
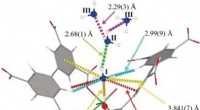 Et robust materiale til optagelse og opbevaring af ammoniak ved tætheder, der kommer tæt på den f…Kredit:Wiley Håndtering, opbevaring, og forsendelse af ammoniak kræver dyrt udstyr og særlige forholdsregler på grund af dets iboende ætsende og toksiske egenskaber. Forskere i Manchester, Storbri
Et robust materiale til optagelse og opbevaring af ammoniak ved tætheder, der kommer tæt på den f…Kredit:Wiley Håndtering, opbevaring, og forsendelse af ammoniak kræver dyrt udstyr og særlige forholdsregler på grund af dets iboende ætsende og toksiske egenskaber. Forskere i Manchester, Storbri -
 Gør trærester til smarte hydrogelerHvordan bio-hydrogeler reagerer på eksterne stimuli og i sidste ende kan nedbrydes i miljøet. Kredit:North Carolina State University NC -statens forskere gør træbiprodukter til sensoriske hydrogel
Gør trærester til smarte hydrogelerHvordan bio-hydrogeler reagerer på eksterne stimuli og i sidste ende kan nedbrydes i miljøet. Kredit:North Carolina State University NC -statens forskere gør træbiprodukter til sensoriske hydrogel -
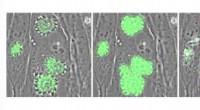 Parasitforskning varmer opIntracellulære Toxoplasma -parasitter, der udtrykker den genetisk kodede calciumindikator GCaMP. Parasitter blev behandlet med A23187, en forbindelse, der forårsager tilstrømning af calcium og stimule
Parasitforskning varmer opIntracellulære Toxoplasma -parasitter, der udtrykker den genetisk kodede calciumindikator GCaMP. Parasitter blev behandlet med A23187, en forbindelse, der forårsager tilstrømning af calcium og stimule -
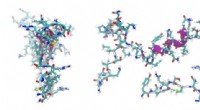 Cellulært stressforsvarKredit:CC0 Public Domain Små varmechokproteiner (sHSPer) er molekylære chaperoner, der binder til udfoldede proteiner for at forhindre proteinaggregering og forsvare mod cellulær stress. Mutatione
Cellulært stressforsvarKredit:CC0 Public Domain Små varmechokproteiner (sHSPer) er molekylære chaperoner, der binder til udfoldede proteiner for at forhindre proteinaggregering og forsvare mod cellulær stress. Mutatione
- Har forskellige typer væsker nogen indflydelse på oxidationshastigheden?
- Håndvævede tekstiler – et skridt på vejen til bæredygtig mode?
- Hvilket udtryk beskriver overførslen af energi mellem objekter, der har forskellige gennemsnitlig…
- Hvad opstår, når kemikalier i levende stof begynder at ændre sig til en type sten?
- Hvorfor Californien bør overveje Australiens 'forbered, bliv og forsvar' politik for skovbrande
- Hvert sandkorn er en metropol for bakterier


