Cellulært stressforsvar
Kredit:CC0 Public Domain
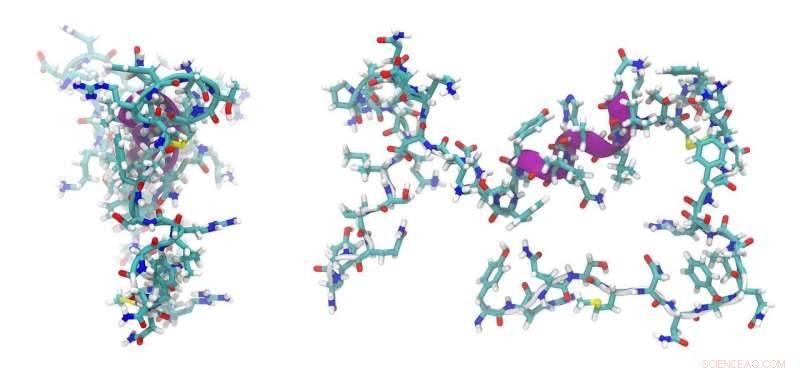
Små varmechokproteiner (sHSP'er) er molekylære chaperoner, der binder til udfoldede proteiner for at forhindre proteinaggregering og forsvare mod cellulær stress. Mutationer i humane sHSP'er er forbundet med arvelige sygdomme, herunder katarakt og kardiomyopati.
Individuelle sHSP'er binder til hinanden for at danne oligomerer. Hassane Mchaourab, Ph.D., og kolleger har tidligere opdaget, at indsættelse af et lille peptid i en bakteriel sHSP kunne få det til at udvide sig fra en 24-underenhedsoligomer til en 48-underenhedsoligomer.
Forskerne spekulerede på, om fleksibilitet i strukturen af oligomerer bidrager til sHSP-funktionen. Nu, i studier ledet af Sanjay Mishra, Ph.D., de viste, at ændring af sekvensen og længden af det indsatte peptid genererer en række oligomerer med 30 til 38 underenheder. Den ikke-ensartede samling af oligomerer bundet til et modelprotein med højere affinitet.
Fundene, rapporteret i journalen Struktur , understøtte en model, hvor modulær sHSP-arkitektur bidrager til sHSP'ers evne til at tjene som chaperoner for en række udfoldede proteiner.
 Varme artikler
Varme artikler
-
 Hvordan forskere opfinder nye farverSommerfuglvinger, ligesom monark sommerfuglens, har inspireret forskere til at skabe strukturelle farver. Kredit:te maeklong/Shutterstock I titusinder af år, mennesker har skabt farver gennem simp
Hvordan forskere opfinder nye farverSommerfuglvinger, ligesom monark sommerfuglens, har inspireret forskere til at skabe strukturelle farver. Kredit:te maeklong/Shutterstock I titusinder af år, mennesker har skabt farver gennem simp -
 En superopløsningsvisning af kemiske reaktionerDen nye metode til dataanalyse fra superopløsningsfluorescenskorrelationsmikroskopi er blevet verificeret, blandt andre, i forsøg, der efterligner det biologiske miljø. Forskere observerede små fluore
En superopløsningsvisning af kemiske reaktionerDen nye metode til dataanalyse fra superopløsningsfluorescenskorrelationsmikroskopi er blevet verificeret, blandt andre, i forsøg, der efterligner det biologiske miljø. Forskere observerede små fluore -
 Kemiemner til collegekurspræsentationerMens kemi oprindeligt kan virke som et tørt emne, kan studerende ved yderligere udforskning finde et udvalg af interessante underemner, der er begravet inden for denne disciplin. Ved at oprette col
Kemiemner til collegekurspræsentationerMens kemi oprindeligt kan virke som et tørt emne, kan studerende ved yderligere udforskning finde et udvalg af interessante underemner, der er begravet inden for denne disciplin. Ved at oprette col -
 At se atomer bevæge sig i hybride perovskitkrystaller afslører spor til forbedring af solcellerDet indvendige bagsidebillede af den 20. november, 2017 udgave af Avancerede materialer illustrerer, hvordan ionmigrering i en hybrid perovskitkrystal påvirker solcellernes ydeevne i forskellige omr
At se atomer bevæge sig i hybride perovskitkrystaller afslører spor til forbedring af solcellerDet indvendige bagsidebillede af den 20. november, 2017 udgave af Avancerede materialer illustrerer, hvordan ionmigrering i en hybrid perovskitkrystal påvirker solcellernes ydeevne i forskellige omr
- Stirrer på stjernestøv
- Scanning tunneling mikroskopi:Computersimuleringer skærper indsigt i molekyler
- British Airways-ejer skifter pilot, da administrerende direktør stopper
- Hvad er der i skovbrandsrøg? En toksikolog forklarer dets farlige komponenter
- Lærere, pædagogiske færdigheder, og intuitionens hindring
- Brug af hvid eddike og isopropylalkohol


