Hvad er bindingsvinklen på CF2H2?
Her er hvorfor:
* Hybridisering: Carbonatomet i CF2H2 gennemgår SP3 -hybridisering. Dette betyder, at det danner fire hybrid orbitaler, der er arrangeret i en tetrahedral form.
* frastødning: De fire elektronpar omkring carbonatomet (to C-F-bindinger, to C-H-bindinger) afviser hinanden for at maksimere afstand og minimere energi.
* Ideel vinkel: I en ideel tetrahedral geometri er bindingsvinklen 109,5 grader.
Den faktiske bindingsvinkel i CF2H2 kan dog være lidt mindre end 109,5 grader. Dette skyldes, at fluoratomerne er mere elektronegative end brintatomer. Dette fører til en svag stigning i elektrondensitet omkring fluoratomerne, hvilket forårsager en større frastødelse mellem C-F-bindingerne og en lidt mindre bindingsvinkel.
Kortfattet: Bindvinklerne i CF2H2 er tæt på 109,5 grader, men lidt mindre på grund af elektronegativiteten af fluor.
Sidste artikelHvilket element er NH4CL?
Næste artikelFormaldehyd og eddikesyre har den samme empiriske formel, men forskellige?
 Varme artikler
Varme artikler
-
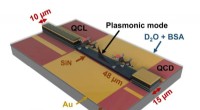 Miniaturiseret lab-on-a-chip til kemisk analyse af væsker i realtidOn-chip sensorkoncept inklusive angivet plasmonisk tilstand. Emitter (QCL, 10 μm bred) og detektor (QCD, 15 μm bred) er forbundet gennem en 48 μm lang tilspidset SiN-baseret plasmonisk bølgeleder. Hel
Miniaturiseret lab-on-a-chip til kemisk analyse af væsker i realtidOn-chip sensorkoncept inklusive angivet plasmonisk tilstand. Emitter (QCL, 10 μm bred) og detektor (QCD, 15 μm bred) er forbundet gennem en 48 μm lang tilspidset SiN-baseret plasmonisk bølgeleder. Hel -
 Roll-up fjernsyn og bøjelige smartphones:Fremtiden for fleksible elektroniske materialerEn måde at visualisere dele af PCDTPT på, de ledende plastmaterialeforskere studeret i dette arbejde, er som en samling af gummiorm. Kredit:Sean Kelley/NIST Har du hørt om foldbare smartphones? Hv
Roll-up fjernsyn og bøjelige smartphones:Fremtiden for fleksible elektroniske materialerEn måde at visualisere dele af PCDTPT på, de ledende plastmaterialeforskere studeret i dette arbejde, er som en samling af gummiorm. Kredit:Sean Kelley/NIST Har du hørt om foldbare smartphones? Hv -
 Kunstige celler-i-celler udløst af lys fungerer som mini-kemiske reaktorerCircles in a Circle af Kandinsky. Kredit:Philadelphia Museum of Art, Louise og Walter Arensbergs Samling, 1950-134-104 Kunstige celler, der frigiver materialer, når de udsættes for lys, er blevet
Kunstige celler-i-celler udløst af lys fungerer som mini-kemiske reaktorerCircles in a Circle af Kandinsky. Kredit:Philadelphia Museum of Art, Louise og Walter Arensbergs Samling, 1950-134-104 Kunstige celler, der frigiver materialer, når de udsættes for lys, er blevet -
 Bakterier spiser drivhusgas med en side af proteinMethanobactinstrukturen (i hvid) og MbnB-proteinstrukturen vist i rødt og blåt Kredit:Amy Rosenzweig Lab, Northwestern University Med evnen til at sive tungmetaller fra miljøet og fordøje en poten
Bakterier spiser drivhusgas med en side af proteinMethanobactinstrukturen (i hvid) og MbnB-proteinstrukturen vist i rødt og blåt Kredit:Amy Rosenzweig Lab, Northwestern University Med evnen til at sive tungmetaller fra miljøet og fordøje en poten
- Hvordan ekstrem kulde kan knække lithium-ion-batterimaterialer og forringe ydeevnen
- Tacoma-baserede Snopes, debunker af falske nyheder, er fastlåst i en grim juridisk tvist
- En måde at få en væske til at bevæge sig gennem en kanal uden drivkraft
- Hvorfor bjerge er i kegleformet?
- Det bedste objektiv til at tage portrætter
- 500 millioner år gammel orm-motorvej opdaget i Canada


