Hvad definerede en syre som et stof, der producerer H plus ioner i opløsning og base OH-opløsning?
Her er en sammenbrud:
Arrhenius -syrer:
* Definition: En Arrhenius -syre er et stof, der, når det opløses i vand, øger koncentrationen af brintioner (H+) i opløsningen.
* Eksempel: Hydrochlorsyre (HCI) dissocierer i vand for at danne H+ og cl- ioner.
* reaktion: HCL (aq) → H + (aq) + Cl- (aq)
Arrhenius baser:
* Definition: En Arrhenius-base er et stof, der, når det opløses i vand, øger koncentrationen af hydroxidioner (OH-) i opløsningen.
* Eksempel: Natriumhydroxid (NaOH) dissocierer i vand for at danne Na+ og OH-ioner.
* reaktion: NaOH (aq) → Na + (aq) + OH- (aq)
Betydningen af Arrhenius -definitionen:
* enkel og praktisk: Det giver en ligetil forklaring af syre-base-opførsel i vand.
* basis for pH: Begrebet pH er direkte knyttet til koncentrationen af H+ -ioner, som er centralt i Arrhenius -definitionen.
Begrænsninger af Arrhenius -definitionen:
* begrænset til vandige løsninger: Det forklarer ikke syre-base-opførsel i ikke-vandige opløsningsmidler.
* redegør ikke for alle baser: Nogle stoffer fungerer som baser, men producerer ikke hydroxidioner, som ammoniak (NH3).
ud over Arrhenius -definitionen:
Senere definitioner, som Brønsted-Lowry-teorien og Lewis-teorien, giver en bredere forståelse af syre-base-kemi. Arrhenius-definitionen er dog stadig vigtig for dens historiske betydning og dens anvendelse på mange hverdags syre-base-reaktioner i vand.
 Varme artikler
Varme artikler
-
 Gekkofødder er belagt med et ultratyndt lag lipider, der hjælper dem med at holde sig klistredeEn illustration af en gekkospatel, en struktur i nanometerskala på dyrets tæer, der bidrager til dets greb. De grønne ark repræsenterer keratinproteiner. De grå kruseduller repræsenterer lipidmolekyle
Gekkofødder er belagt med et ultratyndt lag lipider, der hjælper dem med at holde sig klistredeEn illustration af en gekkospatel, en struktur i nanometerskala på dyrets tæer, der bidrager til dets greb. De grønne ark repræsenterer keratinproteiner. De grå kruseduller repræsenterer lipidmolekyle -
 Træ du kan lide en drink? Japans hold opfinder træspritRåmateriale? Japanske forskere siger, at de har opfundet en måde at producere alkoholholdige drikkevarer fra kirsebærtræer og andre træsorter Kræsne drikkere kan snart blive forgrenet, efter at ja
Træ du kan lide en drink? Japans hold opfinder træspritRåmateriale? Japanske forskere siger, at de har opfundet en måde at producere alkoholholdige drikkevarer fra kirsebærtræer og andre træsorter Kræsne drikkere kan snart blive forgrenet, efter at ja -
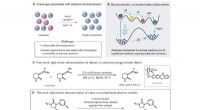 En et-trins multikatalytisk metode til berigelse af racemiske blandinger til en enkelt enantiomerReaktionsudvikling. (A) termodynamiske og kinetiske udfordringer ved at udvikle metoder til selektiv deracemisering. (B) Generelt, lysdrevne strategier for at opnå deracemisering uden for ligevægt gen
En et-trins multikatalytisk metode til berigelse af racemiske blandinger til en enkelt enantiomerReaktionsudvikling. (A) termodynamiske og kinetiske udfordringer ved at udvikle metoder til selektiv deracemisering. (B) Generelt, lysdrevne strategier for at opnå deracemisering uden for ligevægt gen -
 Kunstig intelligens kaster lys over membranydelsenKredit:King Abdullah University of Science and Technology Membranseparationer har længe været anerkendt som energieffektive processer med et hurtigt voksende marked. I særdeleshed, organisk opløsn
Kunstig intelligens kaster lys over membranydelsenKredit:King Abdullah University of Science and Technology Membranseparationer har længe været anerkendt som energieffektive processer med et hurtigt voksende marked. I særdeleshed, organisk opløsn
- Hvad er svovldioxid og nitrogenoxider?
- NASA fanger udviklingen af Tropical Cyclone 02A
- Injicerbar gel lover som sårhelende materiale til slagtilfælde
- Singlet oxygen nedbryder selektivt oxytetracyclin i fentonlignende oxidation
- At løse problemer fra det 21. århundrede kræver færdigheder, som få er trænet i, finder forske…
- Nye bioinspirerede hydrogeler kan fungere som superlim i meget ioniske miljøer som havvand


