Hvorfor er nogle atomer eller molekyler i flydende form og ikke et fast stof?
* attraktive kræfter: Disse holder atomer eller molekyler sammen. De er stærkere i faste stoffer og svagere i væsker.
* kinetisk energi: Dette er bevægelsesenergien. Det er højere i væsker og gasser, hvilket giver molekyler mulighed for at bevæge sig mere frit rundt.
Her er grunden til, at der findes nogle atomer eller molekyler som væsker:
* Mellemstyrke af attraktive kræfter: Væsker har stærkere attraktive kræfter end gasser, men svagere end faste stoffer. Dette betyder, at molekyler holdes sammen, men kan stadig bevæge sig rundt.
* tilstrækkelig kinetisk energi: Molekylerne i væsker har nok kinetisk energi til at overvinde nogle af de attraktive kræfter, så de kan flyde og ændre form.
Tænk på det sådan:
* faste stoffer: Forestil dig en tæt pakket skare, som alle holder fast ved hinanden. Folket kan vibrere, men kan ikke bevæge sig frit.
* væsker: Forestil dig en mængde mennesker, der danser og bevæger sig rundt, men støder stadig på hinanden. De kan bevæge sig frit, men er stadig relativt tæt.
* Gasser: Forestil dig en gruppe mennesker, der løber frit rundt i et stort rum, næppe støder på hinanden.
faktorer, der påvirker stoftilstanden:
* Temperatur: Højere temperaturer øger kinetisk energi, hvilket gør det lettere for molekyler at overvinde attraktive kræfter og blive væsker eller gasser.
* tryk: Forøget tryk skubber molekyler tættere sammen, øger attraktive kræfter og gør det mere sandsynligt, at de vil være i en fast eller flydende tilstand.
* molekylær struktur: Formen og typen af bindinger mellem atomer påvirker styrken af attraktive kræfter. For eksempel har vandmolekyler stærke brintbindinger, der holder dem i en flydende tilstand ved stuetemperatur.
Så i det væsentlige findes væsker, fordi de har en balance mellem attraktive kræfter og kinetisk energi, der giver dem mulighed for at bevæge sig rundt, men stadig være relativt tæt sammen.
 Varme artikler
Varme artikler
-
 Fremstilling af etan fra metan ved hjælp af en fotokemisk looping -strategiÆndringer af Ag – HPW/TiO 2 efter metan fotokemisk kobling. Kredit: Naturenergi (2020). DOI:10.1038/s41560-020-0616-7 Et team af forskere fra universitetet i Lille, CNRS, Centrale Lille, Univer
Fremstilling af etan fra metan ved hjælp af en fotokemisk looping -strategiÆndringer af Ag – HPW/TiO 2 efter metan fotokemisk kobling. Kredit: Naturenergi (2020). DOI:10.1038/s41560-020-0616-7 Et team af forskere fra universitetet i Lille, CNRS, Centrale Lille, Univer -
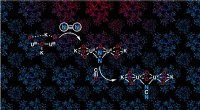 Nitrogenfiksering under omgivende forholdDen oxo-broforbundne uranforbindelse fanger dinitrogen og omdanner dinitrogen og kulilte til cyanamid. Kredit:Marta Falcone/Marinella Mazzanti/EPFL Rigelig i atmosfæren, kvælstof bruges sjældent t
Nitrogenfiksering under omgivende forholdDen oxo-broforbundne uranforbindelse fanger dinitrogen og omdanner dinitrogen og kulilte til cyanamid. Kredit:Marta Falcone/Marinella Mazzanti/EPFL Rigelig i atmosfæren, kvælstof bruges sjældent t -
 Faraday stoffer? MXene-belagt stof kan indeholde elektronisk interferens i bærbare enhederDrexel University-forskere rapporterer, at stof belagt med MXene er 99,9 % effektivt til at blokere elektromagnetisk interferens. Kredit:Drexel University Forskere ved Drexel Universitys College o
Faraday stoffer? MXene-belagt stof kan indeholde elektronisk interferens i bærbare enhederDrexel University-forskere rapporterer, at stof belagt med MXene er 99,9 % effektivt til at blokere elektromagnetisk interferens. Kredit:Drexel University Forskere ved Drexel Universitys College o -
 Stort skridt fremad i produktionen af grøn brintKredit:CC0 Public Domain Den første termodynamisk reversible kemiske reaktor, der er i stand til at producere brint som en ren produktstrøm, repræsenterer et transformationelt skridt fremad i den
Stort skridt fremad i produktionen af grøn brintKredit:CC0 Public Domain Den første termodynamisk reversible kemiske reaktor, der er i stand til at producere brint som en ren produktstrøm, repræsenterer et transformationelt skridt fremad i den
- Infrarød sensor fungerer som et nyt værktøj til opdagelse af lægemidler
- Hvorfor er der næsten ingen ekstruderende ultra basale klipper i jordskorpe?
- Hvad repræsenterer Lengh i en svingning af en pendul?
- Har en rutsjebane potentiel energi?
- Sådan finder du lodrette og vandrette asymptoter
- NASA beordrer akutte rumvandringsreparationer på rumstationen


