Hvordan ændrer ædle gasser sig, når du går ned i gruppen?
1. Atomradius:
* øges: Når du går ned i gruppen, bliver de ædle gasatomer større. Dette skyldes, at du tilføjer en ekstra elektronskal med hvert nyt element.
2. Ioniseringsenergi:
* falder: Det tager mindre energi at fjerne et elektron fra et ædelgasatom, når du går ned i gruppen. Dette skyldes, at den yderste elektron er længere væk fra kernen og mindre stærkt tiltrukket.
3. Kogepunkt:
* øges: Kogepunkterne for ædelgasser øges, når du går ned i gruppen. Dette skyldes den stigende styrke i London Dispersion Forces. Større atomer har flere elektroner, hvilket skaber stærkere midlertidige dipoler og dermed stærkere interatomiske attraktioner.
4. Densitet:
* øges: Tætheden af ædelgasser øges, når du går ned i gruppen. Dette er et resultat af de større atommasser og det faktum, at atomerne er pakket tættere.
5. Reaktivitet:
* øges lidt: Noble gasser er generelt ureaktive på grund af deres fulde ydre elektronskaller (Octet -regel). Når du går ned i gruppen, falder ioniseringsenergien imidlertid. Dette betyder, at de tungere ædle gasser lettere kan ioniseres og kan danne forbindelser under ekstreme forhold (f.eks. XEPTF6).
Sammendragstabel:
| Ejendom | Trend ned i gruppen | Forklaring |
| ------------------- | ---------------------- | --------------------------------------------------------------------------------- |
| Atomradius | Øges | Der tilføjes flere elektronskaller. |
| Ioniseringsenergi | Falder | Det yderste elektron er længere væk fra kernen og mindre tæt bundet. |
| Kogepunkt | Øges | Stærkere London -spredningskræfter på grund af større atomstørrelse. |
| Densitet | Øges | Større atommasser og strammere pakning. |
| Reaktivitet | Lidt øges | Faldende ioniseringsenergi muliggør potentiel sammensat dannelse (sjælden). |
 Varme artikler
Varme artikler
-
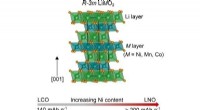 Køreplanen skitserer forhindringer i næste generations katodeudvikling til at drive elektriske kø…Krystalstruktur til lagdelte overgangsmetaloxidkatodematerialer, viser arrangementet af lithium og overgangsmetalkationer på tværs af separate lag. Kredit:Beth Johnston Overgangen til elektriske k
Køreplanen skitserer forhindringer i næste generations katodeudvikling til at drive elektriske kø…Krystalstruktur til lagdelte overgangsmetaloxidkatodematerialer, viser arrangementet af lithium og overgangsmetalkationer på tværs af separate lag. Kredit:Beth Johnston Overgangen til elektriske k -
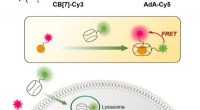 Cellulær genbrug taget på fersk gerningFigur 1:Relativt simpel og billig teknik til at visualisere den cellulære genbrugsmekanisme (autofagi) i realtid. Processen er baseret på bindingen mellem CB [7] og AdA. CB[7] er bundet til det fluore
Cellulær genbrug taget på fersk gerningFigur 1:Relativt simpel og billig teknik til at visualisere den cellulære genbrugsmekanisme (autofagi) i realtid. Processen er baseret på bindingen mellem CB [7] og AdA. CB[7] er bundet til det fluore -
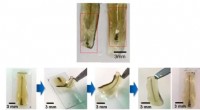 Grænseflade med hjernenNervesystemet er fyldt med kodet information:tanker, følelser, motorstyring. Dette system i vores kroppe er en gåde, og jo mere vi kan gøre for at forstå det, jo mere kan vi gøre for at forbedre menne
Grænseflade med hjernenNervesystemet er fyldt med kodet information:tanker, følelser, motorstyring. Dette system i vores kroppe er en gåde, og jo mere vi kan gøre for at forstå det, jo mere kan vi gøre for at forbedre menne -
 Brug af metal-organiske rammer til at nedbryde plastKredit:Pixabay/CC0 Public Domain Hvad hvis plastikflaskens livscyklus var cirkulær? Hvor en brugt plastikflaske blev returneret til sine originale komponenter, klar til at blive lavet om til en ny
Brug af metal-organiske rammer til at nedbryde plastKredit:Pixabay/CC0 Public Domain Hvad hvis plastikflaskens livscyklus var cirkulær? Hvor en brugt plastikflaske blev returneret til sine originale komponenter, klar til at blive lavet om til en ny
- Hvilken type væv har en apikal og basal overflade?
- Hvorfor blev orkanen Patricia så hurtigt et monster?
- Bevæger solen sig i himlen?
- Vejen til quantum computing er banet i qubits
- Børns mentale sundhed kan kæmpe under onlineskole. Her er, hvordan lærere planlægger fremad.
- Hvilken opskalering bruger videnskabsmænd til at repræsentere atom?


