Hvorfor koge væske ved et lavt tryk?
kogepunkt og damptryk
* kogepunkt: Temperaturen, ved hvilken en væskes damptryk er lig med det omgivende atmosfæriske tryk.
* damptryk: Det tryk, der udøves af dampen af en væske i ligevægt med dens flydende fase.
hvordan tryk påvirker kogepunktet
* lavere tryk: Når det eksterne tryk er lavere, har væskemolekylerne brug for mindre energi for at overvinde kræfterne, der holder dem sammen og undslipper i gasfasen. Dette betyder, at de kan overgå til damp ved en lavere temperatur, hvilket resulterer i et lavere kogepunkt.
* Højere pres: Omvendt kræver væskemolekylerne ved højere tryk mere energi for at overvinde det ydre tryk og flygte ind i gasfasen, hvilket resulterer i et højere kogepunkt.
Eksempel:
Tænk på vandkogning på en bjergtop versus ved havoverfladen:
* bjergtop: Det atmosfæriske tryk er lavere end ved havoverfladen. Dette betyder, at vand koger ved en lavere temperatur på bjergtoppen.
* havniveau: Det atmosfæriske tryk er højere, så vandet er nødt til at nå en højere temperatur for at koge.
Key Takeaway:
Kogepunktet for en væske er direkte relateret til det ydre tryk. Lavere tryk betyder et lavere kogepunkt, og højere tryk betyder et højere kogepunkt.
 Varme artikler
Varme artikler
-
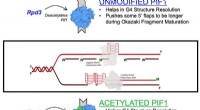 Kræftforbundet enzymmekanisme, der er nyligt karakteriseret i undersøgelseEt diagram, der illustrerer acetylering af Pif1-helicase-enzymet Kredit:Matthew Bochman og Lata Balakrishnan, Indiana University Bloomington/IUPUI En ny undersøgelse ledet af forskere ved IUPUI og
Kræftforbundet enzymmekanisme, der er nyligt karakteriseret i undersøgelseEt diagram, der illustrerer acetylering af Pif1-helicase-enzymet Kredit:Matthew Bochman og Lata Balakrishnan, Indiana University Bloomington/IUPUI En ny undersøgelse ledet af forskere ved IUPUI og -
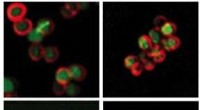 Forskere finder et potentielt potentielt våben til at overvinde antibiotikaresistensPseudomonas aeruginosa-producerede rhamnolipider målretter mod plasmamembranen af Staphylococcus aureus (mærket her med rødt) for at øge permeabiliteten for aminoglycosidantibiotika. Kredit:Conlon L
Forskere finder et potentielt potentielt våben til at overvinde antibiotikaresistensPseudomonas aeruginosa-producerede rhamnolipider målretter mod plasmamembranen af Staphylococcus aureus (mærket her med rødt) for at øge permeabiliteten for aminoglycosidantibiotika. Kredit:Conlon L -
 Fang energi fra sollys med farvestoffer inspireret af naturenDavid Moe Almenningen viser pigmentet, der kan forbedre solcellens ydeevne. Kredit:Vilde Bråten Mens sollys filtrerer gennem en skovkrone, klorofyl arbejder hårdt på at fange fotonernes energi. In
Fang energi fra sollys med farvestoffer inspireret af naturenDavid Moe Almenningen viser pigmentet, der kan forbedre solcellens ydeevne. Kredit:Vilde Bråten Mens sollys filtrerer gennem en skovkrone, klorofyl arbejder hårdt på at fange fotonernes energi. In -
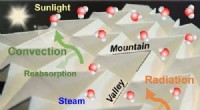 Origami inspirerer til en højeffektiv solar dampgeneratorKredit:American Chemical Society Vand dækker det meste af kloden, men mange regioner lider stadig under mangel på rent drikkevand. Hvis forskerne effektivt og bæredygtigt kunne forvandle havvand t
Origami inspirerer til en højeffektiv solar dampgeneratorKredit:American Chemical Society Vand dækker det meste af kloden, men mange regioner lider stadig under mangel på rent drikkevand. Hvis forskerne effektivt og bæredygtigt kunne forvandle havvand t
- Sådan beregnes Kappa Statistic
- Antikorreleret plasma- og THz-pulsgenerering under tofarvet laserfilamentering i luft
- Forskere udvikler wolfram-baserede brintdetektorer
- Hvordan forbedrer mikroskoper vores liv i dag?
- Forskere har det første 3D-billede af livets processer i væske
- Rocket Lab sender med succes raket i kredsløb


