Når ikke -metaller og metal reagerer, hvilke atomer får elektroner?
Her er hvorfor:
* metaller har en tendens til at miste elektroner, fordi de har relativt få elektroner i deres yderste skal. Dette gør dem elektropositive, og de ønsker at opnå en stabil, fuld ydre skal ved at give væk disse elektroner.
* ikke -metaller på den anden side har mange elektroner i deres ydre skal og ønsker at få elektroner for at fylde den og opnå stabilitet. Dette gør dem til elektronegative.
Når et metal- og ikke -metal reageres, mister metalatomet elektroner og bliver en positivt ladet ion (kation), mens ikke -metalatomet får elektroner og bliver en negativt ladet ion (anion). Disse modsatte ladede ioner tiltrækker derefter hinanden og danner en ionisk forbindelse.
Eksempel:
Natrium (NA), et metal, reagerer med klor (CL), en ikke -metal, til dannelse af natriumchlorid (NaCl).
* Natrium mister en elektron for at blive na⁺.
* Klor får en elektron for at blive Cl⁻.
* De modsatte ladede ioner tiltrækker derefter hinanden og danner den ioniske forbindelse NaCl.
Sidste artikelHvilket metalelement er et giftigt flydende metal?
Næste artikelHvad er opløst stof og et opløst stof?
 Varme artikler
Varme artikler
-
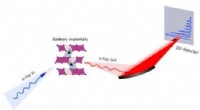 Overbygningens rolle i førstegangsspændingstab i lithium-ion-batterierFigur 1. Den typiske konfiguration af et RIXS-eksperiment. Indkommende røntgenstråler med høj energiopløsning skinner på prøverne, og de spredte røntgenstråler opløses i energi og bliver opsamlet af e
Overbygningens rolle i førstegangsspændingstab i lithium-ion-batterierFigur 1. Den typiske konfiguration af et RIXS-eksperiment. Indkommende røntgenstråler med høj energiopløsning skinner på prøverne, og de spredte røntgenstråler opløses i energi og bliver opsamlet af e -
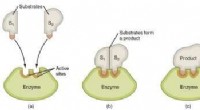 Ændring af perspektivet på oprindelsen af enzymatisk katalytisk kraftGrafisk fremstilling af trinene i en enzymatisk reaktion. Kredit:Wikimedia Commons De enzymer, der findes i levende organismer, har en imponerende katalytisk kraft. Takket være enzymer sker de kemi
Ændring af perspektivet på oprindelsen af enzymatisk katalytisk kraftGrafisk fremstilling af trinene i en enzymatisk reaktion. Kredit:Wikimedia Commons De enzymer, der findes i levende organismer, har en imponerende katalytisk kraft. Takket være enzymer sker de kemi -
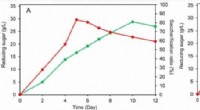 Ny konsolideret bio-saccharificeringsteknik til omdannelse af lignocellulose udvikletForsukring af forbehandlet hvedehalm under optimale eller regelmæssige forhold uden modifikation i både 100-ml anaerobe flasker (a) og en 10-L anaerob fermentor (b). Kredit:LIU Yajun En forskergru
Ny konsolideret bio-saccharificeringsteknik til omdannelse af lignocellulose udvikletForsukring af forbehandlet hvedehalm under optimale eller regelmæssige forhold uden modifikation i både 100-ml anaerobe flasker (a) og en 10-L anaerob fermentor (b). Kredit:LIU Yajun En forskergru -
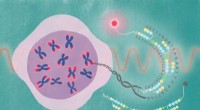 Nær-infrarød sonde afkoder telomerdynamikEn fluorescerende forbindelse blev knyttet til PIPet, der er målrettet mod den gentagne DNA -sekvens, der findes i telomerer. Denne sonde, kaldet SiR-TTet59B, muliggør observation af telomerer i aktio
Nær-infrarød sonde afkoder telomerdynamikEn fluorescerende forbindelse blev knyttet til PIPet, der er målrettet mod den gentagne DNA -sekvens, der findes i telomerer. Denne sonde, kaldet SiR-TTet59B, muliggør observation af telomerer i aktio
- Forskere finder antibiotikaresistente gener udbredt i grundvandet
- Hvor meget for den nobelpris i vinduet?
- Sony køber det meste af EMI Music, at bruge $9B på billedsensorer
- Hvad er et Tektonisk Jordskælv?
- Hvordan energiintensive økonomier kan overleve og trives, når kloden øger klimaindsatsen
- Hvad er uafhængige og afhængige variabler?


