Hvad er den ædle gaselektronkonfiguration af strontiumfluorid?
1. Identificer elementerne og deres gebyrer:
* strontium (SR) er i gruppe 2, så det mister 2 elektroner til at danne SR²⁺.
* fluor (f) er i gruppe 17, så det får 1 elektron til dannelse af f⁻.
2. Bestem elektronkonfigurationer:
* strontium (SR): [KR] 5S²
* SR²⁺ mister sine 2 valenselektroner:[KR]
* fluor (F): [Han] 2S² 2P⁵
* F⁻ vinder 1 elektron for at udfylde sin p orbital:[han] 2s² 2p⁶ =[ne]
3. Kombiner konfigurationerne:
Da vi har to fluorioner (F⁻) for hver strontiumion (SR²⁺), er den endelige ædle gaselektronkonfiguration for strontiumfluorid:
[kr] + 2 [ne]
Derfor er den ædle gaselektronkonfiguration af strontiumfluorid [KR] 2 [NE].
Sidste artikelHvad er opløsningsmiddel og opløsningsmiddel for sodavand?
Næste artikelEt eksempel på et stort kulhydratmolekyle er?
 Varme artikler
Varme artikler
-
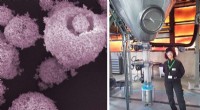 Et skridt hen imod syntese af metalorganiske strukturerKredit:Catalan Institute of Nanoscience and Nanotechnology Dr. Inhar Imaz og ICREA-professor Daniel Maspoch er hjernen bag en ny metode til organisk metalstruktursyntese. Deres spraytørringsteknik
Et skridt hen imod syntese af metalorganiske strukturerKredit:Catalan Institute of Nanoscience and Nanotechnology Dr. Inhar Imaz og ICREA-professor Daniel Maspoch er hjernen bag en ny metode til organisk metalstruktursyntese. Deres spraytørringsteknik -
 Smagsforskning til forbrugerbeskyttelseUdgangspunktet for undersøgelserne var en ren kirsebærjuice lavet af surkirsebær i laboratoriet. Kredit:Gisela Olias / Leibniz-LSB I 2013 den tyske Stiftung Warentest fandt skadelig benzen i drink
Smagsforskning til forbrugerbeskyttelseUdgangspunktet for undersøgelserne var en ren kirsebærjuice lavet af surkirsebær i laboratoriet. Kredit:Gisela Olias / Leibniz-LSB I 2013 den tyske Stiftung Warentest fandt skadelig benzen i drink -
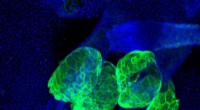 Forskere opdager en ny receptor, der regulerer talgkirtlens stamcellers funktionEmbigin-molekyle (grøn) er stærkt udtrykt i hudcellerne, der differentierer til talgkirtler. Cellernes kerner farves blå; de lange strukturer er hårsække. Kredit:Universitetet i Turku Stamceller og
Forskere opdager en ny receptor, der regulerer talgkirtlens stamcellers funktionEmbigin-molekyle (grøn) er stærkt udtrykt i hudcellerne, der differentierer til talgkirtler. Cellernes kerner farves blå; de lange strukturer er hårsække. Kredit:Universitetet i Turku Stamceller og -
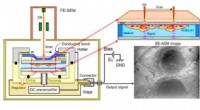 Osteoblastisk lysosom spiller en central rolle i mineraliseringScanning elektron-assisteret dielektrisk mikroskopi (SE-ADM) observation af osteoblaster. (A) Højopløsnings SE-ADM sat op til osteoblastobservation. Væskeprøveholder inklusive osteoblaster er monteret
Osteoblastisk lysosom spiller en central rolle i mineraliseringScanning elektron-assisteret dielektrisk mikroskopi (SE-ADM) observation af osteoblaster. (A) Højopløsnings SE-ADM sat op til osteoblastobservation. Væskeprøveholder inklusive osteoblaster er monteret
- Fællesskabet siger modvilligt farvel til det 600 år gamle træ
- Hvad er Jupiter Surface Terrain?
- Effektiv syntese af ginkgo -forbindelse kan føre til nye lægemidler, grønne insekticider
- Hvad er et eventyrlandskab?
- Globalt økosystem bidrager med billioner i sine tjenester med vigtige synergier og afvejninger, vis…
- Glitter fra sølv lyser op Alzheimers mørke hemmeligheder


