Hvor findes massen til en kemisk reaktion?
Dette princip er kendt som lov om bevarelse af masse , som først blev foreslået af Antoine Lavoisier.
Her er hvad der sker:
* atomer omarrangeres: I en kemisk reaktion oprettes eller ødelægges atomer, at de simpelthen omarrangeres til forskellige kombinationer.
* masse konserveres: Da atomerne i sig selv ikke ændrer sig, forbliver den samlede masse af systemet konstant under hele reaktionen.
Eksempel:
Forestil dig at brænde træ i en brand. Træet (reaktant) reagerer med ilt (reaktant) for at producere aske, kuldioxid og vand (produkter). Mens udseendet ændres drastisk, vil reaktanternes samlede masse (træ + ilt) være lig med den samlede masse af produkterne (aske + kuldioxid + vand).
Vigtig note: Mens den samlede masse bevares, kan massen af individuelle stoffer ændres. I det brændende træeksempel falder for eksempel træets masse, når den forbruges, mens massen af asken, kuldioxid og vand øges.
 Varme artikler
Varme artikler
-
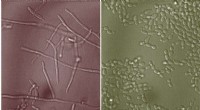 Molekyler fundet i slim kan modvirke svampeinfektionDen mere smitsomme form for gæren Candida albicans er en lang filament (til venstre). MIT-forskere har vist, at når gæren dyrkes i nærværelse af mucinglykaner, forbliver den i sin runde, harmløse form
Molekyler fundet i slim kan modvirke svampeinfektionDen mere smitsomme form for gæren Candida albicans er en lang filament (til venstre). MIT-forskere har vist, at når gæren dyrkes i nærværelse af mucinglykaner, forbliver den i sin runde, harmløse form -
 Meget effektiv, langtidsholdbar elektrokatalysator for at øge produktionen af brintbrændstofKrystalstruktur af iltrig metallegering på overfladen (øverst til venstre). Ilt og brint dannes under en vandelektrolysereaktion (øverst til højre). Den designede katalysator udviser den bedste oxygen
Meget effektiv, langtidsholdbar elektrokatalysator for at øge produktionen af brintbrændstofKrystalstruktur af iltrig metallegering på overfladen (øverst til venstre). Ilt og brint dannes under en vandelektrolysereaktion (øverst til højre). Den designede katalysator udviser den bedste oxygen -
 Aniondoping på højt niveau mod hurtig ladningsoverførselskinetik til kondensatorerKredit:CC0 Public Domain Forskerholdet af prof. Xiaobo Ji og associeret prof. Guoqiang Zou har foreslået en genial ilt-vacancy (OV) ingeniørstrategi for at realisere højt indhold af anionisk dopin
Aniondoping på højt niveau mod hurtig ladningsoverførselskinetik til kondensatorerKredit:CC0 Public Domain Forskerholdet af prof. Xiaobo Ji og associeret prof. Guoqiang Zou har foreslået en genial ilt-vacancy (OV) ingeniørstrategi for at realisere højt indhold af anionisk dopin -
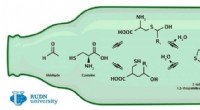 Kemiker foreslår en måde at måle smagen af øl påKredit:RUDN Universitet En kemiker fra RUDN University har udviklet en metode til at analysere produkterne fra binding af aldehyder med aminosyren cystein i malt og øl – disse stoffer kan påvirke
Kemiker foreslår en måde at måle smagen af øl påKredit:RUDN Universitet En kemiker fra RUDN University har udviklet en metode til at analysere produkterne fra binding af aldehyder med aminosyren cystein i malt og øl – disse stoffer kan påvirke
- Udtynding af Antarktis største gletscher er modsat tidligere observeret
- Kvantelys presser støjen ud af mikroskopisignaler
- Er det umuligt for et element at erstatte atomer af anothe i en forbindelse?
- Verdens daglige temperaturrekorder er smadret – her er hvordan vi ved det
- Algoritme giver netværk den mest aktuelle information, der er tilgængelig, samtidig med at dataove…
- Hvorfor kan vi bøje et stykke metal?


