Reagerer stærkere syrer langsommere end svagere syrer?
Her er hvorfor:
* syrestyrke handler om tendensen til at donere en proton (H+) Stærkere syrer donerer protoner lettere.
* reaktionshastighed handler om hastigheden af en reaktion . Det afhænger af flere faktorer, herunder:
* Kollisionsfrekvens: Hvor ofte reaktantmolekyler kolliderer.
* Aktiveringsenergi: Den minimale energi, der kræves for at en reaktion kan forekomme.
* orientering: Hvordan molekyler kolliderer, som skal være gunstige for reaktionen.
stærkere syrer kan reagere hurtigere i nogle tilfælde, fordi:
* de danner mere reaktive mellemprodukter: Den protonerede form af en svagere base er en bedre elektrofil (tiltrækker elektroner) og kan føre til hurtigere reaktioner.
* de kan katalysere reaktioner: Stærkere syrer kan protonere substrater og øge deres reaktivitet.
Det er dog ikke altid sandt:
* Andre faktorer kan påvirke reaktionshastighederne: Arten af basen, opløsningsmidlet, temperatur osv. Spiller alle en rolle.
* svagere syrer kan undertiden reagere hurtigere: Hvis en svagere syre er mere sterisk tilgængelig eller danner et mere stabilt mellemprodukt, kan den reagere hurtigere end en stærkere syre.
Kortfattet:
Syrestyrke og reaktionshastighed er forskellige koncepter. Mens stærkere syrer undertiden kan reagere hurtigere, er det ikke en universel regel. Mange andre faktorer påvirker reaktionshastighederne.
Sidste artikelHvor findes massen til en kemisk reaktion?
Næste artikelHvad er opløsningsmiddel og opløsningsmiddel for sodavand?
 Varme artikler
Varme artikler
-
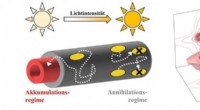 Energiflow i nanoområdetKredit:Billeder:Björn Kriete (v.) / Stefan Mueller (r.) Planter og bakterier kan fange sollysets energi med lys-høstende antenner og overføre den til et reaktionscenter. At transportere energi eff
Energiflow i nanoområdetKredit:Billeder:Björn Kriete (v.) / Stefan Mueller (r.) Planter og bakterier kan fange sollysets energi med lys-høstende antenner og overføre den til et reaktionscenter. At transportere energi eff -
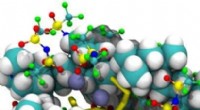 En ny polymer hæver barren for lithium-svovlbatterierDenne illustration viser dannelsen af komplekse ionklynger under cyklussen af en lithium-svovl battericelle. Klyngerne består af kationiske polymerbindere, batterielektrolyt, og anioniske svovlakt
En ny polymer hæver barren for lithium-svovlbatterierDenne illustration viser dannelsen af komplekse ionklynger under cyklussen af en lithium-svovl battericelle. Klyngerne består af kationiske polymerbindere, batterielektrolyt, og anioniske svovlakt -
 Rød, hvid men sjældent blå - videnskaben om fyrværkerifarver, forklaretFyrværkeri er en klasse af eksplosive pyrotekniske enheder, der normalt findes i omkring syv farver. Kredit:Shahril KHMD/Shutterstock.com I de tidligste dage af USA, John Adams skrev til sin kone
Rød, hvid men sjældent blå - videnskaben om fyrværkerifarver, forklaretFyrværkeri er en klasse af eksplosive pyrotekniske enheder, der normalt findes i omkring syv farver. Kredit:Shahril KHMD/Shutterstock.com I de tidligste dage af USA, John Adams skrev til sin kone -
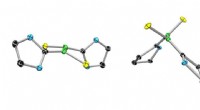 Generering af en stabil biradicalEn konventionel bor-bor dobbeltbinding (venstre) og dens ekstremt stabile biradiske slægtning. Kredit:Dr. Rian Dewhurst Bor har en række anvendelser, fra vaskeblegemiddel til varmebestandigt glas
Generering af en stabil biradicalEn konventionel bor-bor dobbeltbinding (venstre) og dens ekstremt stabile biradiske slægtning. Kredit:Dr. Rian Dewhurst Bor har en række anvendelser, fra vaskeblegemiddel til varmebestandigt glas
- Teknik tilbyder vej til biofremstilling af medicin under rumflyvninger
- Giv et eksempel på en monoprotisk syre?
- Arbejder hårdt eller næsten ikke arbejde? Forsker studerer virkningerne af jobforenkling på medar…
- Hvilke gasser i luften forårsager sur regn?
- Hvor mange inches er lig med 50NB?
- Du kører som en pige:Undersøgelse viser kønsbias i opfattelsen af samkørsel


