Hvorfor er det, at brintet placeret i Alkali Earth Metal Group?
Her er hvorfor:
Ligheder med alkalimetaller:
* Elektronisk konfiguration: Hydrogen har et elektron i sin yderste skal, ligesom alkalimetaller.
* tendens til at miste en elektron: Hydrogen kan miste sit eneste elektron til at danne en positiv ion (H+), svarende til alkalimetaller.
* reagerer med ikke -metaller: Hydrogen reagerer med ikke -metaller, som halogener, for at danne forbindelser som HCI, svarende til alkalimetaller, der reagerer med ikke -metaller.
Ligheder med halogener:
* At få en elektron: Hydrogen kan få et elektron til dannelse af en negativ ion (H-), svarende til halogenerne.
* Dannelse af diatomiske molekyler: Hydrogen findes som et diatomisk molekyle (H2), svarende til halogenerne (F2, CL2, BR2, I2).
* reagerer med metaller: Hydrogen kan reagere med nogle metaller til dannelse af metalhydrider (f.eks. NaH, CAH2), svarende til halogener, der reagerer med metaller for at danne salte.
Imidlertid er brint også unikt:
* lille størrelse og høj elektronegativitet: Brint er meget mindre og har en meget højere elektronegativitet end alkalimetaller.
* danner ikke et metallisk gitter: I modsætning til alkalimetaller danner brint ikke et metallisk gitter i sin faste tilstand.
placering i den periodiske tabel:
Hydrogen anbringes ofte over lithium i gruppe 1, men det er også undertiden placeret over fluor i gruppe 17. Det placeres ofte i en separat kategori af sig selv, fordi den ikke perfekt passer i nogen af grupperne.
I sidste ende er placeringen af brint et spørgsmål om konvention, og det er nyttigt at forstå dets unikke egenskaber og ligheder med både alkalimetaller og halogener.
Sidste artikelHvad er PKA for en .012M opløsning og pH 2,31?
Næste artikelHvad sker der, når der opstår en kemisk ændring?
 Varme artikler
Varme artikler
-
 Stabil forsyning af elektrokrom metallo-supramolekylær polymerDæmpende EC-glas bestående af en metallo-supramolekylær polymer. Kredit:National Institute for Materials Science National Institute for Materials Science (NIMS) og Tokyo Chemical Industry Co., Ltd
Stabil forsyning af elektrokrom metallo-supramolekylær polymerDæmpende EC-glas bestående af en metallo-supramolekylær polymer. Kredit:National Institute for Materials Science National Institute for Materials Science (NIMS) og Tokyo Chemical Industry Co., Ltd -
 Uber medicin levering til kræftpatienterPh.d.-kandidaterne Samantha Wade og Sepehr Talebian, Dr Javad Foroughi, Fornemme professor Gordon Wallace og Dr. Kara Vine-Perrow. Kredit:Alex Pike Kræft er fortsat en af de største dødsårsager
Uber medicin levering til kræftpatienterPh.d.-kandidaterne Samantha Wade og Sepehr Talebian, Dr Javad Foroughi, Fornemme professor Gordon Wallace og Dr. Kara Vine-Perrow. Kredit:Alex Pike Kræft er fortsat en af de største dødsårsager -
 Forskere udvikler en ny tilgang til at forudsige, hvordan væsker fryserKredit:Pixabay/CC0 Public Domain Forskere fra Queen Mary University of London har udviklet en ny beregningsmetode til bedre at forstå frysning i forskellige typer væsker. Processen med at fryse,
Forskere udvikler en ny tilgang til at forudsige, hvordan væsker fryserKredit:Pixabay/CC0 Public Domain Forskere fra Queen Mary University of London har udviklet en ny beregningsmetode til bedre at forstå frysning i forskellige typer væsker. Processen med at fryse, -
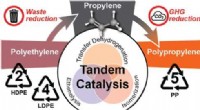 Forskere finder ud af at genbruge plast for at reducere drivhusgasemissionerneGrafisk abstrakt. Kredit:Journal of the American Chemical Society (2022). DOI:10.1021/jacs.2c07781 Forskere fra University of Illinois Urbana-Champaign, University of California, Santa Barbara og D
Forskere finder ud af at genbruge plast for at reducere drivhusgasemissionerneGrafisk abstrakt. Kredit:Journal of the American Chemical Society (2022). DOI:10.1021/jacs.2c07781 Forskere fra University of Illinois Urbana-Champaign, University of California, Santa Barbara og D
- Baby manta rays:Nyt lys kastede over deres liv på indonesisk vandlegeplads
- Hvordan adskiller glacial morænel sig fra stratificeret afdrift beskriver en egenskab lavet af hver…
- Hvad skal DNA blive til for at proteiner skal fremstilles?
- Racialiserede elevers præstationskløfter er en rød advarsel
- Hvordan er elektronkonfigurationen af svovl i overensstemmelse med dannelse NA2S og SF6?
- Har Vega -stjernen et sort hul?


