Hvordan er elektronkonfigurationen af svovl i overensstemmelse med dannelse NA2S og SF6?
Svovls elektronkonfiguration:
* Svovl (er) har et atomnummer på 16, hvilket betyder, at det har 16 protoner og 16 elektroner.
* Dens elektronkonfiguration er:1S² 2S² 2p⁶ 3S² 3P⁴
* Dette betyder, at svovl har 6 valenselektroner (i 3'erne og 3p orbitaler).
Dannelse af Na₂s (natriumsulfid):
* Natrium (NA) er i gruppe 1 i den periodiske tabel, hvilket betyder, at den har 1 valenselektron.
* For at opnå en stabil oktetkonfiguration mister natrium let sin ene valenselektron og bliver en +1 -kation (Na⁺).
* Svovl, med 6 valenselektroner, skal få to elektroner for at afslutte sin oktet.
* To natriumatomer donerer deres valenselektroner til et svovlatom og danner en sulfidion (S²⁻).
* Den elektrostatiske tiltrækning mellem de to natriumkationer (Na⁺) og sulfidanionen (S²⁻) resulterer i de ioniske forbindelser NA₂s.
Dannelse af SF₆ (svovl hexafluorid):
* Fluor (F) er i gruppe 17 (halogener) og har 7 valenselektroner. Det har brug for endnu en elektron for at opnå en stabil oktet.
* Svovl med sine 6 valenselektroner kan danne seks kovalente bindinger med seks fluoratomer.
* Hvert fluoratom deler en elektron med svovl, der afslutter sin oktet, mens svovl udvider sin oktet ud over 8 elektroner.
* Dette resulterer i den kovalente sammensatte SF₆, hvor svovl er omgivet af seks fluoratomer i et meget symmetrisk octahedral geometri.
Nøglepunkter:
* Elektronkonfigurationen af svovl forklarer dens evne til både at vinde elektroner (danne en anion) og dele elektroner (danne kovalente bindinger).
* Svovls tendens til at danne ioniske forbindelser med metaller (som Na) og kovalente forbindelser med ikke -metaller (som F) er en konsekvens af dens elektronkonfiguration og dens ønske om at opnå en stabil octet.
Fortæl mig, hvis du har andre spørgsmål!
Sidste artikelTiltrækker eller frigiver klor elektroner?
Næste artikelHvordan ville du adskille blychlorid fra blanding af og sølvchlorid?
 Varme artikler
Varme artikler
-
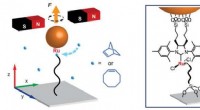 Nærbillede af voksende polymerkæde viser hoppetrinSkematisk af magnetisk pincet måling af en voksende polymer bundet mellem et dækglas og en magnetisk partikel. Monomerer (blå kugler) er inkorporeret af den Ru-baserede katalysator. (Til højre) Forbin
Nærbillede af voksende polymerkæde viser hoppetrinSkematisk af magnetisk pincet måling af en voksende polymer bundet mellem et dækglas og en magnetisk partikel. Monomerer (blå kugler) er inkorporeret af den Ru-baserede katalysator. (Til højre) Forbin -
 En demonstration af billeddannelse i det virkelige rum af nogle af de mest repræsentative former fo…Den skematiske model af solvatiserede protoner i enkeltlagsvand. Blå:solvatiserede protoner af Zundel-typen; Rød:vandmolekyler; Gul:guld substrat. Kredit:Ying Jiang, Peking University Et team af fo
En demonstration af billeddannelse i det virkelige rum af nogle af de mest repræsentative former fo…Den skematiske model af solvatiserede protoner i enkeltlagsvand. Blå:solvatiserede protoner af Zundel-typen; Rød:vandmolekyler; Gul:guld substrat. Kredit:Ying Jiang, Peking University Et team af fo -
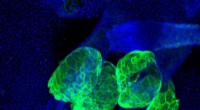 Forskere opdager en ny receptor, der regulerer talgkirtlens stamcellers funktionEmbigin-molekyle (grøn) er stærkt udtrykt i hudcellerne, der differentierer til talgkirtler. Cellernes kerner farves blå; de lange strukturer er hårsække. Kredit:Universitetet i Turku Stamceller og
Forskere opdager en ny receptor, der regulerer talgkirtlens stamcellers funktionEmbigin-molekyle (grøn) er stærkt udtrykt i hudcellerne, der differentierer til talgkirtler. Cellernes kerner farves blå; de lange strukturer er hårsække. Kredit:Universitetet i Turku Stamceller og -
 Kemisk proces nedbryder lignin og gør birketræ til brugbare kemiske produkterDette billede viser den kemiske reaktor, der blev brugt i undersøgelsen til at spalte træ til træmasse og ligninolie. Kredit:KU Leuven Et team af forskere tilknyttet flere institutioner i Belgien
Kemisk proces nedbryder lignin og gør birketræ til brugbare kemiske produkterDette billede viser den kemiske reaktor, der blev brugt i undersøgelsen til at spalte træ til træmasse og ligninolie. Kredit:KU Leuven Et team af forskere tilknyttet flere institutioner i Belgien
- Inumirat produkterne fra den traditionelle bioteknologiske?
- Hvordan flyder energi i orientalsk medicin gennem kroppen?
- Hvordan er hydrogenbinding vigtig for kroppen?
- Hvad er 57F i celsius?
- Det tager år at komme sig helt efter store storme som Sandy
- Hvordan kryptovalutaer kan erstatte andre betalingsmuligheder


